Afghanenmyelopathie
Die Afghanenmyelopathie ist eine vermutlich erblich bedingte Degeneration der weißen Substanz (Leukodystrophie) im Hals- und Brustmark bei Afghanen.
Sie entsteht im ersten Lebensjahr mit Paresen und entwickelt sich binnen weniger Wochen zu einer kompletten Lähmung der vier Gliedmaßen.
Sie entsteht im ersten Lebensjahr mit Paresen und entwickelt sich binnen weniger Wochen zu einer kompletten Lähmung der vier Gliedmaßen.
eingestellt von: ise; Quellennachweis
Ataxie und Myelopathie der Terrier
Die Ataxie und Myelopathie der Terrier (Hereditäre Ataxie) kommt bei Foxterrier und Jack Russell Terrier sowie Parson Russell Terrier vor.
Hierbei tritt ein Abbau der weißen Substanz im Hals- und Brustbereich des Rückenmarks auf. Sie entwickelt sich im Alter von 2 bis 6 Monaten und geht mit weit ausladenden Bewegungen (Hypermetrie) der Vorderbeine, Muskelzittern und breitbeiniger Stellung der Hinterbeine einher. Die Tiere neigen zum Umfallen und können nicht mehr alleine aufstehen.
Beim Jack Russell bzw. Parson Russell Terrier kommt es auch zur Schädigung des Hörnervs mit zunehmender Taubheit.
Hierbei tritt ein Abbau der weißen Substanz im Hals- und Brustbereich des Rückenmarks auf. Sie entwickelt sich im Alter von 2 bis 6 Monaten und geht mit weit ausladenden Bewegungen (Hypermetrie) der Vorderbeine, Muskelzittern und breitbeiniger Stellung der Hinterbeine einher. Die Tiere neigen zum Umfallen und können nicht mehr alleine aufstehen.
Beim Jack Russell bzw. Parson Russell Terrier kommt es auch zur Schädigung des Hörnervs mit zunehmender Taubheit.
eingestellt von: ise; Quellennachweis
Axonopathie des Labradors
Die Axonopathie des Labradors ist eine bei Labrador Retrievern auftretende Degeneration der weißen Substanz. Sie beginnt mit Hinterhandschwäche bereits im Welpenalter und entwickelt sich zu ausgeprägten Hypermetrien mit Neigung zum Umfallen.
eingestellt von: ise; Quellennachweis
Canine Ceroid-Lipofuszinose
Die Canine Ceroid-Lipofuszinose (CCL) ist eine Erbkrankheit bei verschiedenen Hunderassen, welche Körperzellen, insbesondere Nervenzellen schädigt.
Sie entspricht der Neuronalen Ceroid-Lipofuszinose (NCL) des Menschen und wird in der Literatur auch als NCL der Hunde bezeichnet. CCL ist unheilbar und verläuft immer tödlich.
Pathophysiologie
Bei der CCL handelt es sich um eine Gruppe von Lysosomalen Speicherkrankheiten, die je nach Hunderasse auf verschiedenen Mutationen beruht. Sie werden alle einfach autosomal rezessiv vererbt und führen zur kontinuierlichen Einlagerung vom Ceroid und Lipofuszin in den Nervenzellen, wobei das Alter bei der Erstdiagnose und die durchschnittliche Lebenserwartung in Abhängigkeit von der auslösenden Mutation variieren können.
Durch die Einlagerung der Substanzen wird die Funktion der Nervenzellen beeinträchtigt, was zu einer fortschreitenden Degeneration des Nervensystems und entsprechenden neurologischen Symptomen führt.
Klinik
Signalement
Das Alter, in dem die Symptome der Erkrankung zuerst auffällig werden, variiert je nach Rasse zwischen etwa sechs Monaten und sechs bis sieben Jahren. Hunde der Rassen Dalmatiner und Australian Cattle Dog werden normalerweise bereits im ersten Lebensjahr vorgestellt; Chihuahuas, Zwergschnauzer und Dachsbracken zwischen zwei und vier Jahren; Labrador Retriever und Welsh Corgi normalerweise erst ab sechs Jahren. Bei English Cocker Spaniels (1.5-6) und Polski Owczarek Nizinny (0.5-4.5) variiert das Diagnosealter stark. Beim Dackel kommen zwei Formen der Erkrankung vor, die etwa im Alter von neun Monaten bzw. zwischen viereinhalb und sechseinhalb Jahren auf.
Symptome
Die Symptome ergeben sich aus dem Funktionsverlust des Nervensystems, der durch die Einlagerung von Ceroid und Lipofuszin entsteht. Es kommt dabei zu funktionellen Ausfällen wie Ataxie, aber auch zu Veränderungen der Persönlichkeit wie etwa unsicherem Verhalten in vertrauter Umgebung, Demenz, Aggressivität, Desorientierung und Verlust der Stubenreinheit.
Die Symptome verschlimmern sich mit der Zeit.
Genetik und Zuchthygiene
Bisher sind alle bekannten Varianten der CCL als einfach autosomal rezessiv beschrieben.
Daraus ergibt sich, dass die Elterntiere eines betroffenen Hundes sowie alle seine bereits geborenen Nachkommen der 1. Generation sicher Träger sind und zwei Drittel der klinisch gesunden Vollgeschwister befallener Welpen ebenfalls das defekte Allel tragen; sie sind somit von der Zucht auszuschließen.
Bei Rassen, für die ein Gentest vorliegt (American Bulldog, Border Collie, English Setter, Dackel (Gentest nur für die CCL beim Junghund), Tibet-Terrier, können Träger des defekten Allels identifiziert werden. Indem solche Träger nur mit Hunden verpaart werden, bei denen ein Gentest gezeigt hat, dass sie zwei gesunde Allele tragen, kann das klinische Auftreten der Krankheit in der Population vermieden werden.
Sie entspricht der Neuronalen Ceroid-Lipofuszinose (NCL) des Menschen und wird in der Literatur auch als NCL der Hunde bezeichnet. CCL ist unheilbar und verläuft immer tödlich.
Pathophysiologie
Bei der CCL handelt es sich um eine Gruppe von Lysosomalen Speicherkrankheiten, die je nach Hunderasse auf verschiedenen Mutationen beruht. Sie werden alle einfach autosomal rezessiv vererbt und führen zur kontinuierlichen Einlagerung vom Ceroid und Lipofuszin in den Nervenzellen, wobei das Alter bei der Erstdiagnose und die durchschnittliche Lebenserwartung in Abhängigkeit von der auslösenden Mutation variieren können.
Durch die Einlagerung der Substanzen wird die Funktion der Nervenzellen beeinträchtigt, was zu einer fortschreitenden Degeneration des Nervensystems und entsprechenden neurologischen Symptomen führt.
Klinik
Signalement
Das Alter, in dem die Symptome der Erkrankung zuerst auffällig werden, variiert je nach Rasse zwischen etwa sechs Monaten und sechs bis sieben Jahren. Hunde der Rassen Dalmatiner und Australian Cattle Dog werden normalerweise bereits im ersten Lebensjahr vorgestellt; Chihuahuas, Zwergschnauzer und Dachsbracken zwischen zwei und vier Jahren; Labrador Retriever und Welsh Corgi normalerweise erst ab sechs Jahren. Bei English Cocker Spaniels (1.5-6) und Polski Owczarek Nizinny (0.5-4.5) variiert das Diagnosealter stark. Beim Dackel kommen zwei Formen der Erkrankung vor, die etwa im Alter von neun Monaten bzw. zwischen viereinhalb und sechseinhalb Jahren auf.
Symptome
Die Symptome ergeben sich aus dem Funktionsverlust des Nervensystems, der durch die Einlagerung von Ceroid und Lipofuszin entsteht. Es kommt dabei zu funktionellen Ausfällen wie Ataxie, aber auch zu Veränderungen der Persönlichkeit wie etwa unsicherem Verhalten in vertrauter Umgebung, Demenz, Aggressivität, Desorientierung und Verlust der Stubenreinheit.
Die Symptome verschlimmern sich mit der Zeit.
Genetik und Zuchthygiene
Bisher sind alle bekannten Varianten der CCL als einfach autosomal rezessiv beschrieben.
Daraus ergibt sich, dass die Elterntiere eines betroffenen Hundes sowie alle seine bereits geborenen Nachkommen der 1. Generation sicher Träger sind und zwei Drittel der klinisch gesunden Vollgeschwister befallener Welpen ebenfalls das defekte Allel tragen; sie sind somit von der Zucht auszuschließen.
Bei Rassen, für die ein Gentest vorliegt (American Bulldog, Border Collie, English Setter, Dackel (Gentest nur für die CCL beim Junghund), Tibet-Terrier, können Träger des defekten Allels identifiziert werden. Indem solche Träger nur mit Hunden verpaart werden, bei denen ein Gentest gezeigt hat, dass sie zwei gesunde Allele tragen, kann das klinische Auftreten der Krankheit in der Population vermieden werden.
eingestellt von: ise; Quellennachweis
Cauda-equina-Syndrom der Hunde
Das Cauda-equina-Syndrom - auch degenerative lumbosakrale Stenose (DLSS)- ist eine bei älteren Hunden mittelgroßer und großer Rassen häufig auftretende degenerative neurologische Erkrankung, die durch starken Schmerz und im weiteren Verlauf durch Lähmungen gekennzeichnet ist.
Sie entsteht durch eine Kompression der Nervenwurzeln am Ende des Rückenmarks, der sogenannten Cauda equina, infolge degenerativer Prozesse an der Wirbelsäule am Übergang von der Lendenwirbelsäule zum Kreuzbein. Die Krankheit entspricht in vielen Aspekten dem Cauda-equina-Syndrom des Menschen.
Vorkommen
Die degenerative lumbosakrale Stenose ist eine sehr häufige Erkrankung bei älteren Hunden.
Sie tritt vor allem bei Vertretern von Hunderassen auf, die schwerer als 20 kg sind. Eine Ausnahme stellt der Pudel dar, der ebenfalls häufig erkrankt. Von den großen Hunderassen sind insbesondere Deutscher Schäferhund, Riesenschnauzer, Siberian Husky, Dobermann, Rottweiler und Boxer betroffen.
Klinisches Bild
Die klinischen Symptome einer lumbosakralen Stenose entwickeln sich schleichend und werden daher vom Tierbesitzer häufig übersehen oder als „normale“ Alterserscheinungen über längere Zeit nicht ernst genommen.
Betroffene Tiere werden lauffaul, sind unwillig Treppen zu steigen und springen nur noch widerwillig. Die Ursache sind Schmerzen und Lähmungserscheinungen im betroffenen Bereich. Der Schmerz verringert sich nach ausgedehnten Ruhephasen (Boxenruhe) und wird bei Belastung stärker.
Mit dem „Warmlaufen“ kann es wieder zu einer scheinbaren Besserung kommen.
Im weiteren Verlauf der Erkrankung stellen sich leichte Lähmungserscheinungen ein. Sie stellen sich anfangs nur undeutlich dar, wie z. B. in einer stärkeren Winkelung der Hintergliedmaße. Infolge des schleifenden Ganges nutzen sich die Krallen auf der Vorderseite stärker (sog. "Zehenschleifen").
Auch eine progressive Lähmung des Schwanzes ist möglich. Bei Fortschreiten der Erkrankung kommt es zu Muskelatrophie der Nachhandmuskulatur und zu Kot- und Harninkontinenz als Folge der Lähmung der Schließmuskeln von After und Blase.
Diagnostik
Erste Hinweise gibt eine Schmerzreaktion im Lenden-Kreuz-Bereich. Dazu wird der Schwanz überstreckt, die Hüftgelenke überstreckt und ein kräftiger manueller Druck auf den Lenden-Kreuz-Übergang ausgeübt. Die Reflexe der Hintergliedmaße sind häufig ungestört oder zumindest abgeschwächt erhalten.
Als bildgebendes Verfahren findet routinemäßig die Röntgendarstellung Anwendung. Allerdings stellen sich im Röntgenbild Stenosen nicht immer deutlich dar, vor allem wenn eine seitliche Verengung vorliegt. Eine Myelografie kann die Diagnose sichern, allerdings reicht die Hülle der harten Hirnhaut (Dura mater) in 20 % der Fälle nur bis zum letzten Lendenwirbel.
Am sichersten sind Computertomografie und Magnetresonanztomografie, allerdings sind dies auch die teuersten Verfahren und sie sind nur an wenigen tiermedizinischen Einrichtungen verfügbar.
Therapie
In Fällen, in denen nur eine Schmerzsymptomatik vorliegt, kann eine konservative Therapie versucht werden. Sie besteht in strikter Einschränkung der Bewegungsfreiheit, also strenger Boxenruhe, gegebenenfalls mit Einsatz entzündungshemmender Glukokortikoide. Der Erfolg hängt auch vom Temperament des Hundes ab. Wenn es gelingt, ihn von übermäßigem Bewegungen abzubringen, können die arthrotischen Prozesse durch geringere Belastung des Lenden-Kreuz-Übergangs abheilen. Eine Gewichtsreduktion ist bei übergewichtigen Hunden unbedingt anzuraten.
In schweren Fällen ist eine chirurgische Therapie notwendig, die sich nach dem zugrundeliegenden Prozess richtet und darauf abzielt, die Raumforderung und damit den Druck auf die Cauda equina zu beseitigen. Sie kann in einer Entfernung des Wirbelbogens (Laminektomie), krankhaft veränderter Wirbelsäulenteile wie des Zwischenbogenbandes, der Bandscheibe, der Gelenkfortsätze (Fazettektomie) sowie in der Erweiterung der Nervenaustrittslöcher (Foraminektomie) oder der Stabilisierung des Lenden-Kreuz-Ubergangs mittels geeigneter Osteosyntheseverfahren bestehen.
Die Prognose ist meist gut, solange keine deutlichen Lähmungen auftreten. Im Gegensatz zum Rückenmark selbst haben die Nervenfasern der Cauda equina ein recht hohes Regenerationsvermögen. Bei sehr großen und temperamentvollen Hunden ist jedoch mit einer langen Heilungszeit zu rechnen, in der sich Dinge wie strikte Bewegungseinschränkung nur schwierig realisieren lassen.
Sie entsteht durch eine Kompression der Nervenwurzeln am Ende des Rückenmarks, der sogenannten Cauda equina, infolge degenerativer Prozesse an der Wirbelsäule am Übergang von der Lendenwirbelsäule zum Kreuzbein. Die Krankheit entspricht in vielen Aspekten dem Cauda-equina-Syndrom des Menschen.
Vorkommen
Die degenerative lumbosakrale Stenose ist eine sehr häufige Erkrankung bei älteren Hunden.
Sie tritt vor allem bei Vertretern von Hunderassen auf, die schwerer als 20 kg sind. Eine Ausnahme stellt der Pudel dar, der ebenfalls häufig erkrankt. Von den großen Hunderassen sind insbesondere Deutscher Schäferhund, Riesenschnauzer, Siberian Husky, Dobermann, Rottweiler und Boxer betroffen.
Klinisches Bild
Die klinischen Symptome einer lumbosakralen Stenose entwickeln sich schleichend und werden daher vom Tierbesitzer häufig übersehen oder als „normale“ Alterserscheinungen über längere Zeit nicht ernst genommen.
Betroffene Tiere werden lauffaul, sind unwillig Treppen zu steigen und springen nur noch widerwillig. Die Ursache sind Schmerzen und Lähmungserscheinungen im betroffenen Bereich. Der Schmerz verringert sich nach ausgedehnten Ruhephasen (Boxenruhe) und wird bei Belastung stärker.
Mit dem „Warmlaufen“ kann es wieder zu einer scheinbaren Besserung kommen.
Im weiteren Verlauf der Erkrankung stellen sich leichte Lähmungserscheinungen ein. Sie stellen sich anfangs nur undeutlich dar, wie z. B. in einer stärkeren Winkelung der Hintergliedmaße. Infolge des schleifenden Ganges nutzen sich die Krallen auf der Vorderseite stärker (sog. "Zehenschleifen").
Auch eine progressive Lähmung des Schwanzes ist möglich. Bei Fortschreiten der Erkrankung kommt es zu Muskelatrophie der Nachhandmuskulatur und zu Kot- und Harninkontinenz als Folge der Lähmung der Schließmuskeln von After und Blase.
Diagnostik
Erste Hinweise gibt eine Schmerzreaktion im Lenden-Kreuz-Bereich. Dazu wird der Schwanz überstreckt, die Hüftgelenke überstreckt und ein kräftiger manueller Druck auf den Lenden-Kreuz-Übergang ausgeübt. Die Reflexe der Hintergliedmaße sind häufig ungestört oder zumindest abgeschwächt erhalten.
Als bildgebendes Verfahren findet routinemäßig die Röntgendarstellung Anwendung. Allerdings stellen sich im Röntgenbild Stenosen nicht immer deutlich dar, vor allem wenn eine seitliche Verengung vorliegt. Eine Myelografie kann die Diagnose sichern, allerdings reicht die Hülle der harten Hirnhaut (Dura mater) in 20 % der Fälle nur bis zum letzten Lendenwirbel.
Am sichersten sind Computertomografie und Magnetresonanztomografie, allerdings sind dies auch die teuersten Verfahren und sie sind nur an wenigen tiermedizinischen Einrichtungen verfügbar.
Therapie
In Fällen, in denen nur eine Schmerzsymptomatik vorliegt, kann eine konservative Therapie versucht werden. Sie besteht in strikter Einschränkung der Bewegungsfreiheit, also strenger Boxenruhe, gegebenenfalls mit Einsatz entzündungshemmender Glukokortikoide. Der Erfolg hängt auch vom Temperament des Hundes ab. Wenn es gelingt, ihn von übermäßigem Bewegungen abzubringen, können die arthrotischen Prozesse durch geringere Belastung des Lenden-Kreuz-Übergangs abheilen. Eine Gewichtsreduktion ist bei übergewichtigen Hunden unbedingt anzuraten.
In schweren Fällen ist eine chirurgische Therapie notwendig, die sich nach dem zugrundeliegenden Prozess richtet und darauf abzielt, die Raumforderung und damit den Druck auf die Cauda equina zu beseitigen. Sie kann in einer Entfernung des Wirbelbogens (Laminektomie), krankhaft veränderter Wirbelsäulenteile wie des Zwischenbogenbandes, der Bandscheibe, der Gelenkfortsätze (Fazettektomie) sowie in der Erweiterung der Nervenaustrittslöcher (Foraminektomie) oder der Stabilisierung des Lenden-Kreuz-Ubergangs mittels geeigneter Osteosyntheseverfahren bestehen.
Die Prognose ist meist gut, solange keine deutlichen Lähmungen auftreten. Im Gegensatz zum Rückenmark selbst haben die Nervenfasern der Cauda equina ein recht hohes Regenerationsvermögen. Bei sehr großen und temperamentvollen Hunden ist jedoch mit einer langen Heilungszeit zu rechnen, in der sich Dinge wie strikte Bewegungseinschränkung nur schwierig realisieren lassen.
eingestellt von: ise; Quellennachweis
Dackellähme
Als Dackellähme (oder auch Teckellähme) werden die durch einen Bandscheibenvorfall ausgelösten Krankheitssymptome bei Hunden, welche eine genetisch fixierte Knorpelwachstumsstörung (Chondrodystrophie) aufweisen, bezeichnet. Wie der Name bereits sagt, sind hiervon häufig Dackel betroffen, aber auch Pekinesen, Scottish Terrier, Spaniel, Französische Bulldoggen und Zwergpudel sind für die Erkrankung anfällig.
Pathogenese
Die Erkrankung beruht auf einer Degeneration der Bandscheiben. Die somit kaum noch elastische und belastbare Bandscheibe kann somit bereits bei kleineren Belastungen oder Traumen reißen: es kommt zum Vorfall des Bandscheibenkerns oder der gesamten Bandscheibe in den Wirbelkanal hinein.
Hierdurch werden Quetschungen und Schädigungen des Nervengewebes verursacht, welche wiederum entsprechende klinische Ausfallserscheinungen der Nervenfunktion nach sich zieht.
Die Erkrankung tritt vor allem im jüngeren bis mittleren Lebensalter im Alter zwischen zwei und sieben Jahren auf und betrifft vor allem den mechanisch am stärksten beanspruchten Teil der Wirbelsäule zwischen elftem Brust- und drittem Lendenwirbel, seltener die kaudale Lendenwirbelsäule zwischen fünftem Lendenwirbel und Kreuzbein sowie die Halswirbelsäule zwischen dem zweiten und siebten Halswirbel.
Klinik
Die Symptomatik ist durch eine deutliche Bewegungsstörung der betroffenen Tiere gekennzeichnet. Diese ist abhängig von der Schwere des Vorfalls auf Schmerzhaftigkeit im Bereich des Rückens oder auf den mehr oder weniger starken Ausfall von Nervenfunktionen zurückzuführen.
Im Extremfall kommt es zu einer kompletten Lähmung der Beckengliedmaßen mit spastischer Parese oder schlaffer Lähmung. Die Fähigkeit zu Harn- und Kotabsatz ist häufig eingeschränkt. Bei einem Vorfall im Bereich der Halswirbelsäule können analog die Vordergliedmaßen zusätzlich betroffen sein. Bei länger bestehender Symptomatik sind Hautschäden durch Druckstellen möglich.
Diagnose
Gemeinsam mit der Rasse des betroffenen Tieres gibt eine neurologische Untersuchung deutliche Anhaltspunkte für die Lokalisation der Schädigung.
Dagegen ist das Anfertigen einer einfachen Röntgenaufnahme nicht immer hilfreich, da sich die vorgefallenen Bandscheibenanteile meist im Röntgen nicht deutlich nachweisen lassen.
Mittels einer Myelographie ist die Eingrenzung des Schadens jedoch in der Regel möglich. Letzte Sicherheit über das Ausmaß des Schadens kann eine Magnetresonanztomographie geben.
Therapie
Liegt keine hochgradige Schädigung vor, ist eine konservative Therapie mittels Medikamenten (Glukokortikoide, Antiphlogistika, Anabolika und Vitamin-B-Komplex) möglich und zielt auf das Zurückdrängen entzündlicher Reaktionen ab.
Die chirurgische Intervention ist dagegen auf die Druckentlastung des Rückenmarks ausgerichtet, was über Fensterung (Fenestrierung) der Bandscheibe sowie über Entfernung von Teilen des angrenzenden Wirbeldaches (Laminektomie oder Hemilaminektomie) erfolgen kann.
Nach erfolgter Operation kann mittels Physiotherapie die Genesung beschleunigt werden.
Pathogenese
Die Erkrankung beruht auf einer Degeneration der Bandscheiben. Die somit kaum noch elastische und belastbare Bandscheibe kann somit bereits bei kleineren Belastungen oder Traumen reißen: es kommt zum Vorfall des Bandscheibenkerns oder der gesamten Bandscheibe in den Wirbelkanal hinein.
Hierdurch werden Quetschungen und Schädigungen des Nervengewebes verursacht, welche wiederum entsprechende klinische Ausfallserscheinungen der Nervenfunktion nach sich zieht.
Die Erkrankung tritt vor allem im jüngeren bis mittleren Lebensalter im Alter zwischen zwei und sieben Jahren auf und betrifft vor allem den mechanisch am stärksten beanspruchten Teil der Wirbelsäule zwischen elftem Brust- und drittem Lendenwirbel, seltener die kaudale Lendenwirbelsäule zwischen fünftem Lendenwirbel und Kreuzbein sowie die Halswirbelsäule zwischen dem zweiten und siebten Halswirbel.
Klinik
Die Symptomatik ist durch eine deutliche Bewegungsstörung der betroffenen Tiere gekennzeichnet. Diese ist abhängig von der Schwere des Vorfalls auf Schmerzhaftigkeit im Bereich des Rückens oder auf den mehr oder weniger starken Ausfall von Nervenfunktionen zurückzuführen.
Im Extremfall kommt es zu einer kompletten Lähmung der Beckengliedmaßen mit spastischer Parese oder schlaffer Lähmung. Die Fähigkeit zu Harn- und Kotabsatz ist häufig eingeschränkt. Bei einem Vorfall im Bereich der Halswirbelsäule können analog die Vordergliedmaßen zusätzlich betroffen sein. Bei länger bestehender Symptomatik sind Hautschäden durch Druckstellen möglich.
Diagnose
Gemeinsam mit der Rasse des betroffenen Tieres gibt eine neurologische Untersuchung deutliche Anhaltspunkte für die Lokalisation der Schädigung.
Dagegen ist das Anfertigen einer einfachen Röntgenaufnahme nicht immer hilfreich, da sich die vorgefallenen Bandscheibenanteile meist im Röntgen nicht deutlich nachweisen lassen.
Mittels einer Myelographie ist die Eingrenzung des Schadens jedoch in der Regel möglich. Letzte Sicherheit über das Ausmaß des Schadens kann eine Magnetresonanztomographie geben.
Therapie
Liegt keine hochgradige Schädigung vor, ist eine konservative Therapie mittels Medikamenten (Glukokortikoide, Antiphlogistika, Anabolika und Vitamin-B-Komplex) möglich und zielt auf das Zurückdrängen entzündlicher Reaktionen ab.
Die chirurgische Intervention ist dagegen auf die Druckentlastung des Rückenmarks ausgerichtet, was über Fensterung (Fenestrierung) der Bandscheibe sowie über Entfernung von Teilen des angrenzenden Wirbeldaches (Laminektomie oder Hemilaminektomie) erfolgen kann.
Nach erfolgter Operation kann mittels Physiotherapie die Genesung beschleunigt werden.
eingestellt von: ise; Quellennachweis
Dalmatiner-Leukodystrophie
Die Dalmatiner-Leukodystrophie ist eine bei Dalmatinern vorkommende Erbkrankheit mit Entmarkung der weißen Substanz und Schwund des Großhirns mit Erweiterung der Hirnventrikel. Ab dem 3. Lebensmonat entwickeln sich Sehstörungen und Ataxie.
Die Erkrankung führt schnell zum Verlust des Stehvermögens.
Die Erkrankung führt schnell zum Verlust des Stehvermögens.
eingestellt von: ise; Quellennachweis
Dancing Dobermann Disease
Die Dancing Dobermann Disease (engl. für „Tanzender-Dobermann-Krankheit“, ist eine vermutlich degenerativ bedingte neurologische Erkrankung. Sie ist selten und tritt ausschließlich bei Dobermännern und anderen Pinschern auf.
Die Erkrankung tritt bei jungen ausgewachsenen Tieren erstmals auf und verläuft dann allmählich fortschreitend. Das Hauptsymptom ist eine Beugung des Sprunggelenks, zunächst meist einseitig. Diese kommt durch einen Ausfall des Musculus gastrocnemius und des Nervus tibialis zustande. Im weiteren Verlauf kann es zur Lähmung beider Beine (Paraparese), Störung der Propriozeption, einem gesteigerten Patellarsehnenreflex und zu einer Atrophie des Musculus gastrocnemius kommen. Durch die zunehmende Schwäche in der Hinterhand entwickelt sich ein taumelnder, tänzelnder Gang, der der Krankheit ihren Namen gab.
Die Diagnose wird durch Vorbericht, klinisches Bild und eventuell Elektromyografie gestellt. Eine Heilung ist nicht möglich. Da die Erkrankung aber sehr langsam fortschreitet, kann über mehrere Jahre eine angemessene Lebensqualität aufrechterhalten werden.
Die Erkrankung tritt bei jungen ausgewachsenen Tieren erstmals auf und verläuft dann allmählich fortschreitend. Das Hauptsymptom ist eine Beugung des Sprunggelenks, zunächst meist einseitig. Diese kommt durch einen Ausfall des Musculus gastrocnemius und des Nervus tibialis zustande. Im weiteren Verlauf kann es zur Lähmung beider Beine (Paraparese), Störung der Propriozeption, einem gesteigerten Patellarsehnenreflex und zu einer Atrophie des Musculus gastrocnemius kommen. Durch die zunehmende Schwäche in der Hinterhand entwickelt sich ein taumelnder, tänzelnder Gang, der der Krankheit ihren Namen gab.
Die Diagnose wird durch Vorbericht, klinisches Bild und eventuell Elektromyografie gestellt. Eine Heilung ist nicht möglich. Da die Erkrankung aber sehr langsam fortschreitet, kann über mehrere Jahre eine angemessene Lebensqualität aufrechterhalten werden.
eingestellt von: ise; Quellennachweis
Degenerative Myelopathie des Zwergpudels
Die degenerative Myelopathie des Zwergpudels ist eine vermutlich angeborene Demyelinisierung des Rückenmarks und Mittelhirns.
Mit dem 2. bis 4. Lebensmonat entwickeln betroffene Zwergpudel zunehmend Paresen, die schließlich zu einer Lähmung (Tetraplegie) führen können.
Mit dem 2. bis 4. Lebensmonat entwickeln betroffene Zwergpudel zunehmend Paresen, die schließlich zu einer Lähmung (Tetraplegie) führen können.
eingestellt von: ise; Quellennachweis
Degenerative Myelopathien der Hunde
Als Degenerative Myelopathien der Hunde fasst man eine Reihe langsam verlaufender neurologischer Erkrankungen zusammen, die mit einer Zerstörung des Rückenmarks einhergehen.
Diese Erkrankungen gehen mit langsam fortschreitenden Bewegungsstörungen der Hinterhand einher und sind nicht schmerzhaft. Eine Behandlung ist wenig erfolgversprechend. Die Degenerative Myelopathien der Hunde lassen sich nach der Altersverteilung in zwei große Gruppen einteilen, in die der alten Hunde und die der Junghunde.
Degenerative Myelopathie älterer Hunde
Die Degenerative Myelopathie älterer Hunde ist relativ häufig, besonders bekannt ist sie beim Deutschen Schäferhund. Sie entwickelt sich ab dem 5. Lebensjahr. Ursächlich ist eine Mutation des SOD1-Gens verantwortlich.Die Erkrankung ist durch eine Degeneration des Myelins im Brust- und Lendenteil des Rückenmarks gekennzeichnet. Dadurch entwickeln sich allmählich unkoordinierte Bewegungen der Hinterhand, eine gestörte Eigenwahrnehmung und gestörte Reflexe. Die Erkrankung ist nicht schmerzhaft.
Die Diagnose wird zumeist nach dem Ausschlussverfahren gestellt, sie kann nur nach Autopsie als sicher betrachtet werden. Vor allem ein Bandscheibenvorfall und eine Fibrokartilaginöse Embolie (beide treten akut auf), Cauda-equina-Syndrom und Wobbler-Syndrom (Röntgen, Myelografie) und schließlich Tumoren des Rückenmarks müssen ausgeschlossen werden. In der Rückenmarksflüssigkeit kann eine leichte Erhöhung des Proteingehalts auftreten. Eine Magnetresonanztomographie kann die Diagnose sichern, ist in der Tiermedizin aber nur selten verfügbar. Typisch und für die Abgrenzung zu anderen Erkrankungen wichtig, verläuft degenerative Myelopathie schmerzlos.
Mittels Physiotherapie, täglichem Laufen oder Schwimmen kann versucht werden, den Muskelschwund aufzuhalten. Behandlungsversuche wurden mit Prednisolon, Aminocapronsäure, N-Acetylcystein, Vitamin E, Vitamin C und Vitamin B-Komplex durchgeführt. Alle Medikationen zeigen nach einer aktuellen Studie keine erhöhte Wirksamkeit gegenüber der Physiotherapie und konnten den Krankheitsverlauf nicht aufhalten. Die Prognose ist daher schlecht und oftmals bleibt nur die Einschläferung, um dem erkrankten Tier unnötiges Leiden zu ersparen.
Degenerative Myelopathien der Junghunde
Im Gegensatz zur Degenerativen Myelopathie älterer Hunde sind die Degenerativen Myelopathien der Junghunde insgesamt sehr selten. Sie können allesamt nicht therapiert werden und haben eine schlechte Prognose. Differentialdiagnostisch müssen bei diesen Erkrankungen vor allem angeborene Fehlbildungen des Rückenmarks (Syringomyelie, Hydromyelie) und infektiöse Erkrankungen (Toxoplasmose, Neosporose, Staupe) berücksichtigt werden.
Die Spinale Muskelatrophie
(Stockard disease) ist eine degenerative Erkrankung der grauen Substanz, insbesondere der Motoneurone. Sie tritt bei Rottweiler, Deutscher Dogge, Dobermann, English Pointer, Epagneul Breton und Lapphund auf. Beim Epagneul Breton wurde ein autosomal-dominanter Erbgang nachgewiesen. Die Erkrankung beginnt im Welpenalter mit Atrophie der Rückenmuskulatur, später entwickeln sich Paresen oder sogar Paralysen. Bei Rottweilern kann sich ein Megaösophagus entwickeln (siehe auch Spinale Muskelatrophie des Menschen).
Die Progressive Degeneration des Ibiza-Hundes
ist eine mit den ersten Gehversuchen bei Ibiza-Welpen in Erscheinung tretende progressive Lähmung. Sie beginnt an der Hinterhand und greift dann auch auf die Vorderhand über. Spastizität und Dysmetrien kommen hinzu, gelegentlich werden auch Anfälle beobachtet.
Diese Erkrankungen gehen mit langsam fortschreitenden Bewegungsstörungen der Hinterhand einher und sind nicht schmerzhaft. Eine Behandlung ist wenig erfolgversprechend. Die Degenerative Myelopathien der Hunde lassen sich nach der Altersverteilung in zwei große Gruppen einteilen, in die der alten Hunde und die der Junghunde.
Degenerative Myelopathie älterer Hunde
Die Degenerative Myelopathie älterer Hunde ist relativ häufig, besonders bekannt ist sie beim Deutschen Schäferhund. Sie entwickelt sich ab dem 5. Lebensjahr. Ursächlich ist eine Mutation des SOD1-Gens verantwortlich.Die Erkrankung ist durch eine Degeneration des Myelins im Brust- und Lendenteil des Rückenmarks gekennzeichnet. Dadurch entwickeln sich allmählich unkoordinierte Bewegungen der Hinterhand, eine gestörte Eigenwahrnehmung und gestörte Reflexe. Die Erkrankung ist nicht schmerzhaft.
Die Diagnose wird zumeist nach dem Ausschlussverfahren gestellt, sie kann nur nach Autopsie als sicher betrachtet werden. Vor allem ein Bandscheibenvorfall und eine Fibrokartilaginöse Embolie (beide treten akut auf), Cauda-equina-Syndrom und Wobbler-Syndrom (Röntgen, Myelografie) und schließlich Tumoren des Rückenmarks müssen ausgeschlossen werden. In der Rückenmarksflüssigkeit kann eine leichte Erhöhung des Proteingehalts auftreten. Eine Magnetresonanztomographie kann die Diagnose sichern, ist in der Tiermedizin aber nur selten verfügbar. Typisch und für die Abgrenzung zu anderen Erkrankungen wichtig, verläuft degenerative Myelopathie schmerzlos.
Mittels Physiotherapie, täglichem Laufen oder Schwimmen kann versucht werden, den Muskelschwund aufzuhalten. Behandlungsversuche wurden mit Prednisolon, Aminocapronsäure, N-Acetylcystein, Vitamin E, Vitamin C und Vitamin B-Komplex durchgeführt. Alle Medikationen zeigen nach einer aktuellen Studie keine erhöhte Wirksamkeit gegenüber der Physiotherapie und konnten den Krankheitsverlauf nicht aufhalten. Die Prognose ist daher schlecht und oftmals bleibt nur die Einschläferung, um dem erkrankten Tier unnötiges Leiden zu ersparen.
Degenerative Myelopathien der Junghunde
Im Gegensatz zur Degenerativen Myelopathie älterer Hunde sind die Degenerativen Myelopathien der Junghunde insgesamt sehr selten. Sie können allesamt nicht therapiert werden und haben eine schlechte Prognose. Differentialdiagnostisch müssen bei diesen Erkrankungen vor allem angeborene Fehlbildungen des Rückenmarks (Syringomyelie, Hydromyelie) und infektiöse Erkrankungen (Toxoplasmose, Neosporose, Staupe) berücksichtigt werden.
Die Spinale Muskelatrophie
(Stockard disease) ist eine degenerative Erkrankung der grauen Substanz, insbesondere der Motoneurone. Sie tritt bei Rottweiler, Deutscher Dogge, Dobermann, English Pointer, Epagneul Breton und Lapphund auf. Beim Epagneul Breton wurde ein autosomal-dominanter Erbgang nachgewiesen. Die Erkrankung beginnt im Welpenalter mit Atrophie der Rückenmuskulatur, später entwickeln sich Paresen oder sogar Paralysen. Bei Rottweilern kann sich ein Megaösophagus entwickeln (siehe auch Spinale Muskelatrophie des Menschen).
Die Progressive Degeneration des Ibiza-Hundes
ist eine mit den ersten Gehversuchen bei Ibiza-Welpen in Erscheinung tretende progressive Lähmung. Sie beginnt an der Hinterhand und greift dann auch auf die Vorderhand über. Spastizität und Dysmetrien kommen hinzu, gelegentlich werden auch Anfälle beobachtet.
eingestellt von: ise; Quellen- und Bildnachweis
x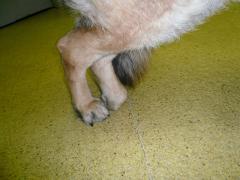

Quellen- und Bildnachweis

Bildname:
Degenerative Myelopathie beim Hund
Urheber:
Wikipedia/Joelmills
Link:
Fibrinoide Leukodystrophie
Die Fibrinoide Leukodystrophie (Alexander's Disease) ist eine sehr selten auftretende Erkrankung bei Labrador Retrievern, Scottish Terriern und Zwergpudeln. Die Ursache ist ungeklärt.
Die Erkrankung führt zu einer Degeneration der Astrozyten (Zellen des zentralen Nervernsystems). Sie beginnt zwischen drittem und sechstem Lebensmonat mit Hinterhandparese, Ataxie und zunehmender Schwäche. Es können auch Verhaltensänderungen und bei Scottish Terriern Anfälle auftreten.
Die Erkrankung führt zu einer Degeneration der Astrozyten (Zellen des zentralen Nervernsystems). Sie beginnt zwischen drittem und sechstem Lebensmonat mit Hinterhandparese, Ataxie und zunehmender Schwäche. Es können auch Verhaltensänderungen und bei Scottish Terriern Anfälle auftreten.
eingestellt von: ise; Quellennachweis
Fibrokartilaginöse Embolie
Die Fibrokartilaginöse Embolie (faserknorplige Embolie) ist eine spezielle Form eines Rückenmarksinfarkts und eine häufige Erkrankung bei Hunden.
Der Infarkt des Rückenmarks wird durch Eindringen von Faserknorpel in die Blutgefäße ausgelöst. Die Erkrankung kann bei allen Hunderassen auftreten, vermehrt wird sie bei älteren Tieren großer Rassen beobachtet.
Entstehung
Bei der fibrokartilaginösen Embolie gelangt faserknorpeliges Material aus den Bandscheiben der Wirbelsäule in die Rückenmarksäste der Blutgefäße. Wie dies geschieht, ist bislang ungeklärt. Das Bandscheibenmaterial führt zu einer Verlegung des Lumens der Blutgefäße und damit zu einem Infarkt des entsprechenden Rückenmarksegments. Aufgrund der nun bestehenden Sauerstoffunterver-sorgung kommt es zu einem Zelluntergang in der weißen und grauen Substanz im Rückenmark.
Klinisches Bild
Eine fibrokartilaginöse Embolie entwickelt sich zumeist akut oder sogar perakut.
Das klinische Bild hängt von der Lokalisation und dem Ausmaß des Infarkts ab. Am häufigsten betroffen sind der Hals- und der Lendenbereich des Rückenmarks. Die Ausfallserscheinungen sind häufig einseitig und können in Lähmungen (Hemiparese) und Ausfall der Sensibilität bestehen.
Bei schweren Infarkten sind auch Paraparesen (Lähmung beider Hintergliedmaßen) und Tetraparesen (Lähmung aller Gliedmaßen) möglich.
Diagnose
Da eine Magnetresonanztomografie in der Tiermedizin nur selten verfügbar ist, erfolgt die Diagnose im Ausschlussverfahren.
Von den häufigeren Erkrankungen muss vorberichtlich ein akutes Trauma des Rückenmarks sowie über eine Myelografie ein Bandscheibenvorfall ausgeschlossen werden.
Die Meningitis-Arteriitis des Hundes zeigt nie akute Lähmungserscheinungen, diese entwickeln sich allmählich, ebenso bei Tumoren des Rückenmarks und degenerative Myelopathien. Eine Myelitis kann mit Untersuchung des Liquor cerebrospinalis und Anfertigung eines Blutbilds ausgeschlossen werden.
Das Wobbler-Syndrom entwickelt sich allmählich und ist eher durch Ataxien als durch Lähmungen gekennzeichnet und kann mittels Röntgen und Myelografie diagnostiziert werden. Beim Cauda-equina-Syndrom (Degenerative lumbosakrale Stenose) dominieren Schmerzen und pathologische Reflexe, Lähmungen sind selten, akute kommen nie vor.
Deutlich seltenere Erkrankungen des Rückenmarks bei Hunden müssen gegebenenfalls ebenfalls in Erwägung gezogen werden.
Therapie und Prognose
Eine wirksame Therapie existiert nicht.
In der Initialphase kann die Gabe von entzündungshemmenden Glucocorticoiden (Prednisolon, Dexamethason), im weiteren Verlauf mit Physiotherapie eine Verbesserung des Zustands versucht werden.
Die Prognose ist abhängig vom Grad der Ausfallserscheinungen, bei fehlender Schmerzwahrnehmung ist sie eher schlecht.
Hier besteht meist wenig Hoffnung, dass sich die Lähmungen zurückbilden, eine Einschläferung sollte in diesen Fällen in Betracht gezogen werden.
Der Infarkt des Rückenmarks wird durch Eindringen von Faserknorpel in die Blutgefäße ausgelöst. Die Erkrankung kann bei allen Hunderassen auftreten, vermehrt wird sie bei älteren Tieren großer Rassen beobachtet.
Entstehung
Bei der fibrokartilaginösen Embolie gelangt faserknorpeliges Material aus den Bandscheiben der Wirbelsäule in die Rückenmarksäste der Blutgefäße. Wie dies geschieht, ist bislang ungeklärt. Das Bandscheibenmaterial führt zu einer Verlegung des Lumens der Blutgefäße und damit zu einem Infarkt des entsprechenden Rückenmarksegments. Aufgrund der nun bestehenden Sauerstoffunterver-sorgung kommt es zu einem Zelluntergang in der weißen und grauen Substanz im Rückenmark.
Klinisches Bild
Eine fibrokartilaginöse Embolie entwickelt sich zumeist akut oder sogar perakut.
Das klinische Bild hängt von der Lokalisation und dem Ausmaß des Infarkts ab. Am häufigsten betroffen sind der Hals- und der Lendenbereich des Rückenmarks. Die Ausfallserscheinungen sind häufig einseitig und können in Lähmungen (Hemiparese) und Ausfall der Sensibilität bestehen.
Bei schweren Infarkten sind auch Paraparesen (Lähmung beider Hintergliedmaßen) und Tetraparesen (Lähmung aller Gliedmaßen) möglich.
Diagnose
Da eine Magnetresonanztomografie in der Tiermedizin nur selten verfügbar ist, erfolgt die Diagnose im Ausschlussverfahren.
Von den häufigeren Erkrankungen muss vorberichtlich ein akutes Trauma des Rückenmarks sowie über eine Myelografie ein Bandscheibenvorfall ausgeschlossen werden.
Die Meningitis-Arteriitis des Hundes zeigt nie akute Lähmungserscheinungen, diese entwickeln sich allmählich, ebenso bei Tumoren des Rückenmarks und degenerative Myelopathien. Eine Myelitis kann mit Untersuchung des Liquor cerebrospinalis und Anfertigung eines Blutbilds ausgeschlossen werden.
Das Wobbler-Syndrom entwickelt sich allmählich und ist eher durch Ataxien als durch Lähmungen gekennzeichnet und kann mittels Röntgen und Myelografie diagnostiziert werden. Beim Cauda-equina-Syndrom (Degenerative lumbosakrale Stenose) dominieren Schmerzen und pathologische Reflexe, Lähmungen sind selten, akute kommen nie vor.
Deutlich seltenere Erkrankungen des Rückenmarks bei Hunden müssen gegebenenfalls ebenfalls in Erwägung gezogen werden.
Therapie und Prognose
Eine wirksame Therapie existiert nicht.
In der Initialphase kann die Gabe von entzündungshemmenden Glucocorticoiden (Prednisolon, Dexamethason), im weiteren Verlauf mit Physiotherapie eine Verbesserung des Zustands versucht werden.
Die Prognose ist abhängig vom Grad der Ausfallserscheinungen, bei fehlender Schmerzwahrnehmung ist sie eher schlecht.
Hier besteht meist wenig Hoffnung, dass sich die Lähmungen zurückbilden, eine Einschläferung sollte in diesen Fällen in Betracht gezogen werden.
eingestellt von: ise; Quellennachweis
Granulomatöse Meningoenzephalitis
Die Granulomatöse Meningoenzephalitis ist eine bei Hunden gelegentlich vorkommende, weltweit verbreitete Entzündung der Hirnhaut und des Gehirns (Meningoenzephalitis). Betroffen sind in Europa vor allem Hunde mittleren bis hohen Alters.
Klinisches Bild
Die Ausprägung der Krankheitssymptome und dem Grad der neurologischen Ausfälle variiert je nach Lokalisation.
Bei der häufigsten Form, der Stammhirnerkrankung, zeigen sich Ausfälle der Hirnnerven (vor allem Fazialislähmung, Glossopharyngeuslähmung), Störungen der Motorik durch Schädigung der motorischen Bahnen und auch Überempfindlichkeit (Hyperästhesie) im Halsbereich. Bei Schädigung des Sehnervs können Sehverlust bis zur Blindheit und eine Reduktion oder ein Ausfall des Pupillenreflexes auftreten.
Diagnose
Die Erkrankung ist klinisch nicht von anderen Stammhirnentzündungen abzugrenzen. Insbesondere Infektionskrankheiten wie Staupe, Tollwut, Aujeszkysche Krankheit, Neosporose und Toxoplasmose müssen ausgeschlossen werden, da diese beim Hund häufig ebenfalls mit einer Stammhirnsymptomatik einhergehen.
Eine sichere Diagnose kann nur pathologisch erstellt werden, unter Umständen auch an Bioptaten von Entzündungsherden, die allerdings am lebenden Tier schwierig zu gewinnen sind.
Therapie
Eine kausale Therapie existiert nicht, da die Krankheitsursache nicht bekannt ist.
Bevor ein Therapieversuch unternommen wird, sollten alle infektiösen Erkrankungen ausgeschlossen werden, da sie durch den Behandlungsversuch verschlimmert werden oder, im Fall von Tollwut, die Behandlung tierseuchenrechtlich verboten ist.
Die Prognose für eine Heilung sind schlecht.
Am erfolgversprechendsten für eine Verzögerung des Krankheitsverlaufs und damit für die Lebensverlängerung ist die immunsuppressive Verabreichung von Glukokortikoiden. Auch Bestrahlung oder Chemotherapie sind als Therapieempfehlung beschrieben.
Klinisches Bild
Die Ausprägung der Krankheitssymptome und dem Grad der neurologischen Ausfälle variiert je nach Lokalisation.
Bei der häufigsten Form, der Stammhirnerkrankung, zeigen sich Ausfälle der Hirnnerven (vor allem Fazialislähmung, Glossopharyngeuslähmung), Störungen der Motorik durch Schädigung der motorischen Bahnen und auch Überempfindlichkeit (Hyperästhesie) im Halsbereich. Bei Schädigung des Sehnervs können Sehverlust bis zur Blindheit und eine Reduktion oder ein Ausfall des Pupillenreflexes auftreten.
Diagnose
Die Erkrankung ist klinisch nicht von anderen Stammhirnentzündungen abzugrenzen. Insbesondere Infektionskrankheiten wie Staupe, Tollwut, Aujeszkysche Krankheit, Neosporose und Toxoplasmose müssen ausgeschlossen werden, da diese beim Hund häufig ebenfalls mit einer Stammhirnsymptomatik einhergehen.
Eine sichere Diagnose kann nur pathologisch erstellt werden, unter Umständen auch an Bioptaten von Entzündungsherden, die allerdings am lebenden Tier schwierig zu gewinnen sind.
Therapie
Eine kausale Therapie existiert nicht, da die Krankheitsursache nicht bekannt ist.
Bevor ein Therapieversuch unternommen wird, sollten alle infektiösen Erkrankungen ausgeschlossen werden, da sie durch den Behandlungsversuch verschlimmert werden oder, im Fall von Tollwut, die Behandlung tierseuchenrechtlich verboten ist.
Die Prognose für eine Heilung sind schlecht.
Am erfolgversprechendsten für eine Verzögerung des Krankheitsverlaufs und damit für die Lebensverlängerung ist die immunsuppressive Verabreichung von Glukokortikoiden. Auch Bestrahlung oder Chemotherapie sind als Therapieempfehlung beschrieben.
eingestellt von: ise; Quellennachweis
Hound-Ataxie
Die Hound-Ataxie tritt bei Beagle und English Foxhound auf.
Als Ursache wird eine überwiegende Fütterung von Pansen diskutiert. Sie entsteht im 2.–7. Lebensjahr infolge einer Degeneration der weißen Substanz im Brustmark und der grauen Substanz im Hirnstamm und zeigt sich in Bewegungsstörungen, spastischer Parese und vermindertem Pannikulusreflex.
Als Ursache wird eine überwiegende Fütterung von Pansen diskutiert. Sie entsteht im 2.–7. Lebensjahr infolge einer Degeneration der weißen Substanz im Brustmark und der grauen Substanz im Hirnstamm und zeigt sich in Bewegungsstörungen, spastischer Parese und vermindertem Pannikulusreflex.
eingestellt von: ise; Quellennachweis
Kaumuskelmyositis
Die Kaumuskelmyositis ist eine gelegentlich bei Hunden auftretende Autoimmunerkrankung, die durch eine Entzündung der Kaumuskulatur gekennzeichnet ist.
Die Erkrankung führt zu Störungen der Beweglichkeit des Unterkiefers und damit zur Behinderung der Nahrungs- und Flüssigkeitsaufnahme. Bei rechtzeitiger Behandlung ist die Heilungsaussicht gut, bei der chronischen Form dagegen fraglich.
Vorkommen und Pathogenese
Die Kaumuskelmyositis tritt bei Hunden aller Rassen und Altersklassen auf. Eine Häufung wird für den Deutschen Schäferhund, den Dobermann sowie alle Retrieverrassen beschrieben. Es erkranken bevorzugt Tiere jungen und mittleren Alters. Eine Geschlechtsdisposition scheint nicht zu bestehen.
Klinisches Bild
Die akute Kaumuskelmyositis ist durch eine beidseitige Schwellung der Kaumuskulatur seitlich am Kopf gekennzeichnet. Die Region ist häufig schmerzhaft. Das betroffene Tier zeigt zumeist eine verminderte Nahrungs- und Flüssigkeitsaufnahme. Gelegentlich wird Fieber beobachtet; eine Vergrößerung der Kehlgangslymphknoten und der Mandeln tritt ebenfalls in einigen Fällen auf.
Bei der Blutuntersuchung kann eine leichte Erhöhung der Aktivität der Kreatinkinase und gelegentlich eine Eosinophilie beobachtet werden (daher der veraltete Name Myositis eosinophilica).
Die häufiger auftretende chronische Kaumuskelmyositis ist durch eine Schrumpfung der Kaumuskeln gekennzeichnet, wodurch der Kopf im seitlich-hinteren Bereich schmal („fuchsschädelig“) aussieht. Durch den bindegewebigen Ersatz der Muskulatur wird der Unterkiefer zunehmend, sowohl aktiv als auch passiv, nur noch eingeschränkt beweglich.
Dies kann bis zu einer Maulsperre (Pseudo-Trismus) führen. In einigen Fällen treten die Augäpfel infolge des Verlustes an Muskelmasse tief in die Augenhöhlen zurück. Eine chronische Kaumuskelmyositis kann sich aus der akuten Form heraus entwickeln oder davon unabhängig auftreten.
Diagnose
Die klinische Verdachtsdiagnose kann durch ein Elektromyogramm (EMG) untermauert werden, bei welchem sich Veränderungen ausschließlich in der Kaumuskulatur finden. Eine Biopsie mit anschließendem histologischen Nachweis der Faserschäden oder der Nachweis der Autoantikörper gelten als beweisend für das Vorliegen der Erkrankung.
Therapie
Der Therapieerfolg hängt maßgeblich vom rechtzeitigen Behandlungsbeginn ab.
Eine akute Kaumuskelmyositis ist meist therapierbar, die chronische Form hat dagegen eine unsichere Prognose. Die Therapie der akuten Form erfolgt durch Gabe von Glukokortikoiden, eventuell in Kombination mit Azathioprin.
Diese Wirkstoffe dämpfen das Immunsystem (sogenannte Immunsuppressiva) und somit die krankhafte Reaktion im Muskelgewebe. Die Behandlungsdauer richtet sich nach dem Behandlungserfolg und eventuellen Rezidiven und kann bis zu sechs Monate betragen.
Bei der chronischen Form kann eine mehrmalige Dehnung der Kaumuskulatur in Narkose versucht werden; diese Methode wird allerdings kontrovers diskutiert, da nach Meinung der Gegner dieser Methode eine vorhandene Entzündung noch verstärkt werden kann und die Gefahr von Luxationen und Frakturen des Unterkiefers besteht.
Auch Physiotherapie und das Animieren zu aktivem Kauen (Kauknochen) kann versucht werden.
Die Erkrankung führt zu Störungen der Beweglichkeit des Unterkiefers und damit zur Behinderung der Nahrungs- und Flüssigkeitsaufnahme. Bei rechtzeitiger Behandlung ist die Heilungsaussicht gut, bei der chronischen Form dagegen fraglich.
Vorkommen und Pathogenese
Die Kaumuskelmyositis tritt bei Hunden aller Rassen und Altersklassen auf. Eine Häufung wird für den Deutschen Schäferhund, den Dobermann sowie alle Retrieverrassen beschrieben. Es erkranken bevorzugt Tiere jungen und mittleren Alters. Eine Geschlechtsdisposition scheint nicht zu bestehen.
Klinisches Bild
Die akute Kaumuskelmyositis ist durch eine beidseitige Schwellung der Kaumuskulatur seitlich am Kopf gekennzeichnet. Die Region ist häufig schmerzhaft. Das betroffene Tier zeigt zumeist eine verminderte Nahrungs- und Flüssigkeitsaufnahme. Gelegentlich wird Fieber beobachtet; eine Vergrößerung der Kehlgangslymphknoten und der Mandeln tritt ebenfalls in einigen Fällen auf.
Bei der Blutuntersuchung kann eine leichte Erhöhung der Aktivität der Kreatinkinase und gelegentlich eine Eosinophilie beobachtet werden (daher der veraltete Name Myositis eosinophilica).
Die häufiger auftretende chronische Kaumuskelmyositis ist durch eine Schrumpfung der Kaumuskeln gekennzeichnet, wodurch der Kopf im seitlich-hinteren Bereich schmal („fuchsschädelig“) aussieht. Durch den bindegewebigen Ersatz der Muskulatur wird der Unterkiefer zunehmend, sowohl aktiv als auch passiv, nur noch eingeschränkt beweglich.
Dies kann bis zu einer Maulsperre (Pseudo-Trismus) führen. In einigen Fällen treten die Augäpfel infolge des Verlustes an Muskelmasse tief in die Augenhöhlen zurück. Eine chronische Kaumuskelmyositis kann sich aus der akuten Form heraus entwickeln oder davon unabhängig auftreten.
Diagnose
Die klinische Verdachtsdiagnose kann durch ein Elektromyogramm (EMG) untermauert werden, bei welchem sich Veränderungen ausschließlich in der Kaumuskulatur finden. Eine Biopsie mit anschließendem histologischen Nachweis der Faserschäden oder der Nachweis der Autoantikörper gelten als beweisend für das Vorliegen der Erkrankung.
Therapie
Der Therapieerfolg hängt maßgeblich vom rechtzeitigen Behandlungsbeginn ab.
Eine akute Kaumuskelmyositis ist meist therapierbar, die chronische Form hat dagegen eine unsichere Prognose. Die Therapie der akuten Form erfolgt durch Gabe von Glukokortikoiden, eventuell in Kombination mit Azathioprin.
Diese Wirkstoffe dämpfen das Immunsystem (sogenannte Immunsuppressiva) und somit die krankhafte Reaktion im Muskelgewebe. Die Behandlungsdauer richtet sich nach dem Behandlungserfolg und eventuellen Rezidiven und kann bis zu sechs Monate betragen.
Bei der chronischen Form kann eine mehrmalige Dehnung der Kaumuskulatur in Narkose versucht werden; diese Methode wird allerdings kontrovers diskutiert, da nach Meinung der Gegner dieser Methode eine vorhandene Entzündung noch verstärkt werden kann und die Gefahr von Luxationen und Frakturen des Unterkiefers besteht.
Auch Physiotherapie und das Animieren zu aktivem Kauen (Kauknochen) kann versucht werden.
eingestellt von: ise; Quellen- und Bildnachweis
x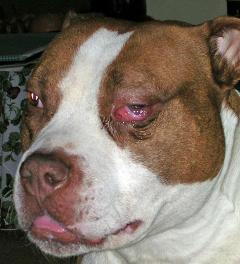

Quellen- und Bildnachweis

Bildname:
Akute Kaumuskelmyositis bei einem American Pit Bull Terrier
Urheber:
Wikipedia/PBarak
Link:
Kokzygeale Myopathie
Die Kokzygeale Myopathie oder „Schwanzmuskelleiden“, ist eine seltene neurologische Erkrankung bei Hunden. Sie zeigt sich in Schmerzhaftigkeit am Schwanzansatz und einer Schwanzlähmung. Die Erkrankung heilt meist ohne Behandlung binnen weniger Tage aus.
Vorkommen und Krankheitentstehung
Die Kokzygeale Myopathie kommt vor allem bei jugendlichen und jungen ausgewachsenen Hunden vor. Besonders häufig betroffen sind Pointer und Retriever.
Die genaue Ursache ist unbekannt. Als prädisponierende Faktoren gelten Überbelastung, Schwimmen in kaltem Wasser, nasskaltes Wetter, schlechter Trainingszustand und Käfigtransporte. Vermutet wird eine Durchblutungsstörung im Bereich der Schwanzmuskulatur mit Untergang von Muskelfasern, also eine vaskulär bedingte Störung gemäß dem VETAMIN D-Schema.
Klinik und Diagnostik
Die Erkrankung tritt akut auf und zeigt sich in einer Berührungsüberempfindlichkeit am Schwanzansatz und einer schlaffen Lähmung der Rute. Betroffene Tiere zeigen aufgrund der Schmerzhaftigkeit häufig eine abgesenkte Kruppe und vermeiden es, sich hinzusetzen.
Labormedizinisch zeigt sich ein Anstieg der Creatin-Kinase, die Diagnose wird zumeist anhand des klinischen Bildes und des Vorberichts gestellt. Eine Elektromyografie kann die Diagnose sichern.
Differentialdiagnostisch müssen Schwanzfrakturen, Cauda-equina-Syndrom, Erkrankungen des Lenden- und Kreuzteils des Rückenmarks, aber auch der Analbeutel und der Prostata ausgeschlossen werden.
Behandlung
Die Kokzygeale Myopathie heilt auch ohne Behandlung zumeist binnen weniger Tage aus. Gegebenenfalls können nichtsteroidale Antirheumatika eingesetzt werden.
Die Prognose ist gut, Rezidive sind selten.
Vorkommen und Krankheitentstehung
Die Kokzygeale Myopathie kommt vor allem bei jugendlichen und jungen ausgewachsenen Hunden vor. Besonders häufig betroffen sind Pointer und Retriever.
Die genaue Ursache ist unbekannt. Als prädisponierende Faktoren gelten Überbelastung, Schwimmen in kaltem Wasser, nasskaltes Wetter, schlechter Trainingszustand und Käfigtransporte. Vermutet wird eine Durchblutungsstörung im Bereich der Schwanzmuskulatur mit Untergang von Muskelfasern, also eine vaskulär bedingte Störung gemäß dem VETAMIN D-Schema.
Klinik und Diagnostik
Die Erkrankung tritt akut auf und zeigt sich in einer Berührungsüberempfindlichkeit am Schwanzansatz und einer schlaffen Lähmung der Rute. Betroffene Tiere zeigen aufgrund der Schmerzhaftigkeit häufig eine abgesenkte Kruppe und vermeiden es, sich hinzusetzen.
Labormedizinisch zeigt sich ein Anstieg der Creatin-Kinase, die Diagnose wird zumeist anhand des klinischen Bildes und des Vorberichts gestellt. Eine Elektromyografie kann die Diagnose sichern.
Differentialdiagnostisch müssen Schwanzfrakturen, Cauda-equina-Syndrom, Erkrankungen des Lenden- und Kreuzteils des Rückenmarks, aber auch der Analbeutel und der Prostata ausgeschlossen werden.
Behandlung
Die Kokzygeale Myopathie heilt auch ohne Behandlung zumeist binnen weniger Tage aus. Gegebenenfalls können nichtsteroidale Antirheumatika eingesetzt werden.
Die Prognose ist gut, Rezidive sind selten.
eingestellt von: ise; Quellennachweis
Kongenitales Vestibularsyndrom
Das Kongenitale Vestibularsyndrom (auch Kongenitales Vestibulärsyndrom) ist eine seltene Erbkrankheit bei Hunden infolge einer Fehlbildung des Gleichgewichtsorgans im Innenohr. Sie äußert sich in Kopfschiefhaltung, Koordinationsstörungen und häufig auch Taubheit.
Vorkommen und Ursachen
Das Kongenitale Vestibularsyndrom tritt bei einigen Rassen gehäuft auf.
Vermutet wird ein autosomal-rezessiver Erbgang. Bei Hunden sind vor allem Akita-Inu, Cocker Spaniel, Deutscher Schäferhund, Dobermann und Tibet-Terrier betroffen.
Betroffene Tiere zeigen eine Fehlbildung des Gleichgewichtsorgans mit fehlenden oder missgebildeten Statolithen sowie häufig auch eine Degeneration der Haarzellen des Corti-Organs in der Hörschnecke.
Klinik
Die Erkrankung zeigt erste Symptome innerhalb des ersten Lebensmonats.
Dabei treten Kopfschiefhaltung und Gleichgewichtsstörungen mit Neigung zum Umfallen und leichten Bewegungsstörungen. Meist tritt gleichzeitig eine ein- oder beidseitige Taubheit auf, die durch einen Hörtest oder eine Hirnstammaudiometrie nachgewiesen werden kann. Ein Augenzittern (Nystagmus) tritt, im Gegensatz zu den meisten anderen Gleichgewichtserkrankungen, nicht auf, allerdings lässt sich oft auch kein physiologischer Nystagmus auslösen.
Die Diagnose lässt sich anhand der Rasse- und Altersprädisposition und dem klinischen Bild stellen.
Eine Behandlung ist nicht möglich.
Der Krankheitsverlauf ist sehr variabel. Zumeist stellt sich ab dem 2. Lebensmonat eine Besserung ein, da die Funktionsstörung des Gleichgewichtsorgans durch andere Sinne (Gesichtssinn, Propriozeption) ausgeglichen wird, so dass trotz Taubheit ein weitgehend beschwerdefreies Leben möglich ist.
Betroffene Tiere sollten allerdings von der Zucht ausgeschlossen werden.
Vorkommen und Ursachen
Das Kongenitale Vestibularsyndrom tritt bei einigen Rassen gehäuft auf.
Vermutet wird ein autosomal-rezessiver Erbgang. Bei Hunden sind vor allem Akita-Inu, Cocker Spaniel, Deutscher Schäferhund, Dobermann und Tibet-Terrier betroffen.
Betroffene Tiere zeigen eine Fehlbildung des Gleichgewichtsorgans mit fehlenden oder missgebildeten Statolithen sowie häufig auch eine Degeneration der Haarzellen des Corti-Organs in der Hörschnecke.
Klinik
Die Erkrankung zeigt erste Symptome innerhalb des ersten Lebensmonats.
Dabei treten Kopfschiefhaltung und Gleichgewichtsstörungen mit Neigung zum Umfallen und leichten Bewegungsstörungen. Meist tritt gleichzeitig eine ein- oder beidseitige Taubheit auf, die durch einen Hörtest oder eine Hirnstammaudiometrie nachgewiesen werden kann. Ein Augenzittern (Nystagmus) tritt, im Gegensatz zu den meisten anderen Gleichgewichtserkrankungen, nicht auf, allerdings lässt sich oft auch kein physiologischer Nystagmus auslösen.
Die Diagnose lässt sich anhand der Rasse- und Altersprädisposition und dem klinischen Bild stellen.
Eine Behandlung ist nicht möglich.
Der Krankheitsverlauf ist sehr variabel. Zumeist stellt sich ab dem 2. Lebensmonat eine Besserung ein, da die Funktionsstörung des Gleichgewichtsorgans durch andere Sinne (Gesichtssinn, Propriozeption) ausgeglichen wird, so dass trotz Taubheit ein weitgehend beschwerdefreies Leben möglich ist.
Betroffene Tiere sollten allerdings von der Zucht ausgeschlossen werden.
eingestellt von: ise; Quellennachweis
Leukoenzephalomyelopathie des Rottweilers
Die Leukoenzephalomyelopathie des Rottweilers ist eine vermutlich erblich bedingte Demyelinisierung des gesamten Zentralnervensystems, am stärksten im Rückenmark und Hirnstamm, bei Rottweilern.
Sie entwickelt sich innerhalb der ersten drei Lebensjahre als fortschreitende Ataxie. Die Rückenmarksreflexe bleiben erhalten. Innerhalb eines halben Jahres können betroffene Tiere nicht mehr aufstehen und stehen.
Sie entwickelt sich innerhalb der ersten drei Lebensjahre als fortschreitende Ataxie. Die Rückenmarksreflexe bleiben erhalten. Innerhalb eines halben Jahres können betroffene Tiere nicht mehr aufstehen und stehen.
eingestellt von: ise; Quellennachweis
MDR1-Defekt
Der MDR1-Defekt ist ein Defekt im MDR1-Gen, der bei einigen Hunderassen verbreitet ist.
Dadurch kommt es zu einer mangelhaften oder fehlenden Synthese eines bestimmten Proteins (P-Glykoprotein, P-gp), welches ein wichtiger Bestandteil der Blut-Hirn-Schranke ist, was zu einer Überempfindlichkeit gegenüber manchen Arzneimitteln führt. Urheber dieses Defektes ist wahrscheinlich ein einziger Hund, der etwa Mitte des 19. Jahrhunderts gelebt hat und maßgeblich an der Entstehung und Festigung der Rasse Collie beteiligt war. Daher lässt sich dieser Defekt bei Hunderassen finden, die nachweisbar mit dem Collie verwandt sind.
Bei anderen vom Defekt betroffenen Rassen dient diese Mutation dann als Nachweis der Verwandtschaft. Ein funktionierendes MDR1-System ist vor allem bei Säugetieren (und Menschen) bekannt und hier evolutionsgeschichtlich sehr alt. Tiere, die dieses System nicht besitzen, können ähnliche Empfindlichkeiten für Medikamente zeigen.
Betroffene Rassen
Die Projektgruppe MDR1-Defekt beim Collie an der Justus-Liebig-Universität Gießen hat im Jahr 2004 im Rahmen einer Studie zur Häufigkeit des MDR1-Defektes bei verschiedenen Hunderassen Hunde aus 30 verschiedenen Rassen und 10 Europäischen Ländern getestet.
Der Defekt im MDR1-Gen wurde u. a. bei folgenden Hunderassen gefunden: Collie (Kurzhaarcollie und Langhaarcollie), Shetland Sheepdog, Australian Shepherd, Bobtail und Border-Collie. Obwohl bisher noch keine nt230(del4) Mutation beim Bearded Collie nachgewiesen werden konnte, lässt die geringe Probenzahl noch keine endgültige Bewertung zu. Bei den Rassen Wäller und Bobtail konnten bisher nur heterozygot von diesem Defekt betroffene Hunde (MDR1+/-) nachgewiesen werden, mit dem Auftreten homozygoter Mutationen müsste allerdings auch bei diesen Rassen gerechnet werden.
Beim Wäller ist es jedoch so, dass die Zuchttiere getestet sein müssen und bei der Verpaarung darauf geachtet wird, ein Trägertier nur mit einem freien zu verpaaren, damit es eben nicht zu homozygoten Welpen kommt.
Des Weiteren ist der Defekt bei folgenden Rassen bekannt: Deutscher Schäferhund, English Shepherd, McNab, Silken Windhound, Langhaarwhippet, Berger Blanc Suisse sowie einigen seltenen Rassen.
Seit Anfang 2008 werden außerdem weitere Rassen wie Barsoi, Belgischer Schäferhund oder Kelpie auf den Defekt untersucht.
Symptome, Diagnostik und Folgen für das Tier
Der Defekt im MDR1-Gen führt zu einer mangelhaften oder fehlenden Synthese des P-Glycoproteins. Dieses Eiweiß spielt eine Rolle bei ATP-abhängigen Transportvorgängen zwischen Blut und Gewebe und ist im Gehirn, in Leber, Nieren, Darm, Plazenta und Hoden zu finden. Neben seiner Funktion beim Transport körperfremder Stoffe, limitiert es den Transport der Hormone der Nebennierenrinde (Cortisol, Corticosteron) in das Gehirn und hat damit Einfluss auf die Hypothalamus-Hypophyse-Nebennierenrinden-Achse. Bei einem MDR1-Defekt kommt es daher zu einem erhöhten Übergang der Nebennierenrindenhormone in die übergeordneten Zentren und aufgrund des negativen Feedbacks zu erniedrigten Kortisolwerten im Blut.
Als eine weitere Folge des Defektes wird auch eine höhere Anfälligkeit für chronisch entzündliche Darmerkrankungen vermutet.
Bei nicht vom Defekt betroffenen Tieren dient dieses Protein u. a. dazu, körperfremde Stoffe wie Arzneimittel aus dem Körper herauszutransportieren. Es besteht also eine Art Resistenz gegenüber unerwünschten Nebenwirkungen – die sogenannte Multiple Drug Resistance.
Bekannt sind bisher die Auswirkungen auf die Blut-Hirn-Schranke. Bei dieser Grenze zwischen den Hirnblutgefässen und dem Hirnnervengewebe stellt ein sogenannter MDR1-Transporter eine Schutzbarriere für das Gehirn dar. Dieser Transporter ist Teil der Blut-Hirn-Schranke und befindet sich normalerweise auf der Oberfläche der Endothelzellen (Zellen, die die Wände der Blutgefäße auskleiden). Er sorgt dafür, dass toxische Verbindungen und Arzneistoffe in den Gehirnkapillaren zurückgehalten werden und nicht in das Gehirn eindringen können.
Besteht nun bei einem Hund der MDR1-Defekt, fehlt der Transporter und der Schutz funktioniert nicht mehr. Bei betroffenen Tieren können daher nach der Verabreichung von bestimmten Antiparasitika, Zytostatika, Durchfallmitteln oder Antibiotika starke neurotoxische Nebenwirkungen auftreten − bis zum Tod. Bei Mäusen, bei welchen der MDR1-Transporter bewusst ausgeschaltet wurde, traten nicht nur Ivermectin, sondern auch zahlreiche andere Arzneistoffe bis zu 90-fach mehr ins Gehirn als bei Vergleichstieren mit intakter Blut-Hirn-Schranke. Diese Stoffe sind auch eine potentielle Gefahr für einen vom MDR1-Defekt betroffenen Hund.
Mögliche Folge dieses Gendefektes ist die Überempfindlichkeit des Hundes gegenüber bestimmten Arzneistoffen. Da die Gabe einiger dieser Mittel bei betroffenen Hunden allerdings zum Tode führen kann, wird ein Gentest aller Hunde betroffener Rassen empfohlen. Die Universität Gießen bietet einen Test auf den MDR1-Defekt an. Zu diesem Zweck nimmt der Tierarzt dem zu untersuchenden Hund eine kleine Menge Blut ab (1 ml EDTA-Blut) und sendet diese Probe an die Universität. Mit Hilfe eines genetischen Tests wird die Blutprobe dann auf ein Vorliegen der MDR1-Mutation untersucht, dass Ergebnis wird dem Hundehalter mitgeteilt.
Ist der Hund vom Defekt betroffen, hat der Hundehalter einige Dinge zu beachten. So dürfen beispielsweise bestimmte Wurmkuren und Flohschutzmittel nicht mehr verabreicht werden. Auch bei Durchfall oder Herzerkrankungen eingesetzte Medikamente können weitreichende unerwünschte Nebenwirkungen haben. Bekannt ist eine Überempfindlichkeit z. B. für die Wirkstoffe Ivermectin, Doramectin, Moxidectin (nur bei oraler Anwendung) und Loperamid. Milbemycinoxim und Emodepsid dürfen nur unter exakter Dosierung eingesetzt werden. Viele weitere Wirkstoffe stehen aber in dem Verdacht, unerwünschte Nebenwirkungen hervorrufen zu können. Generell sollte daher der behandelnde Tierarzt über den Defekt informiert werden. Der Hund selber gilt als Risikopatient.
Bei Spaziergängen ist dann darauf zu achten, dass der Hund keinen Kot von beispielsweise Pferden zu sich nimmt, da dieser einen der gefährlichen Wirkstoffe in unveränderter Form enthalten kann.
Bisher sind Überempfindlichkeiten vor allen bei Hunden mit homozygoter Vererbung des MDR1-Defektes (MDR1 -/-) bekannt. Inzwischen wurden aber auch Reaktionen bei Trägern (MDR1 +/-) beobachtet. In einer US-amerikanischen Studie (siehe unter Links) werden die Träger deshalb als „sensitive“ bezeichnet, die vom Defekt betroffenen Hunde (MDR1 -/-) als „super sensitive“. Ebenfalls in den USA wurden die vom Defekt betroffenen Hunde inzwischen von der Forschung als Versuchstiere entdeckt.
Auswirkungen auf die Zucht
Aufgrund der Probleme in der Arzneitherapie von Hunden mit dem Genotyp MDR1(-/-) wird z. B. von der Universität in Gießen empfohlen, den Gendefekt in der Zucht betroffener Hunderassen zu berücksichtigen und so zu verpaaren, dass keine vom Defekt betroffenen Nachkommen entstehen können. Der MDR1-Genotyp eines Hundes ergibt sich aus der Kombination eines von väterlicher (+ oder -) und eines von mütterlicher Seite (+ oder -) vererbten Merkmals. „+“ steht dabei für ein intaktes MDR1-Gen und „-“ für ein defektes MDR1-Gen bezogen auf das Merkmal MDR1 nt230(del4). Für den MDR1-Genotyp eines Hundes gibt es drei verschiedene Möglichkeiten:
Nicht betroffen - MDR1(+/+), Merkmalsträger - MDR1(+/-) und Betroffen - MDR1(-/-).
Ist der MDR1-Genotyp zweier Zuchttiere bekannt, kann bereits eine theoretische Voraussage über die MDR1-Genotypen der Nachkommengeneration getroffen werden. Betroffene Tiere mit dem Genotyp MDR1(-/-) können aus einer Kreuzung der Genotypen MDR1(+/-) x MDR1(+/-), MDR1(+/-) x MDR1(-/-) oder MDR1(-/-) x MDR1(-/-) entstehen. Bei Kreuzung der Genotypen MDR1(+/+) x MDR1(-/-), MDR1(+/+) x MDR1(+/-), und MDR1(+/+) x MDR1(+/+) entstehen dagegen keine betroffenen MDR1(-/-) Tiere, aber außer bei MDR1(+/+) x MDR1(+/+) unter Umständen wieder Merkmalsträger.
Nachdem einige dem Verband für das Deutsche Hundewesen (VDH) angeschlossenen Zuchtvereine schon von sich aus diese Verpaarungsregeln beachtet hatten, hat der VDH diese den ihm angeschlossenen Collie- und Sheltiezuchtvereinen im Juni 2009 auferlegt. Ab November 2009 müssen nun sämtliche Zuchttiere auf den MDR1-Defekt getestet werden.
Ziel ist, keine vom Defekt betroffenen Nachkommen mehr zu erzeugen.
Dadurch kommt es zu einer mangelhaften oder fehlenden Synthese eines bestimmten Proteins (P-Glykoprotein, P-gp), welches ein wichtiger Bestandteil der Blut-Hirn-Schranke ist, was zu einer Überempfindlichkeit gegenüber manchen Arzneimitteln führt. Urheber dieses Defektes ist wahrscheinlich ein einziger Hund, der etwa Mitte des 19. Jahrhunderts gelebt hat und maßgeblich an der Entstehung und Festigung der Rasse Collie beteiligt war. Daher lässt sich dieser Defekt bei Hunderassen finden, die nachweisbar mit dem Collie verwandt sind.
Bei anderen vom Defekt betroffenen Rassen dient diese Mutation dann als Nachweis der Verwandtschaft. Ein funktionierendes MDR1-System ist vor allem bei Säugetieren (und Menschen) bekannt und hier evolutionsgeschichtlich sehr alt. Tiere, die dieses System nicht besitzen, können ähnliche Empfindlichkeiten für Medikamente zeigen.
Betroffene Rassen
Die Projektgruppe MDR1-Defekt beim Collie an der Justus-Liebig-Universität Gießen hat im Jahr 2004 im Rahmen einer Studie zur Häufigkeit des MDR1-Defektes bei verschiedenen Hunderassen Hunde aus 30 verschiedenen Rassen und 10 Europäischen Ländern getestet.
Der Defekt im MDR1-Gen wurde u. a. bei folgenden Hunderassen gefunden: Collie (Kurzhaarcollie und Langhaarcollie), Shetland Sheepdog, Australian Shepherd, Bobtail und Border-Collie. Obwohl bisher noch keine nt230(del4) Mutation beim Bearded Collie nachgewiesen werden konnte, lässt die geringe Probenzahl noch keine endgültige Bewertung zu. Bei den Rassen Wäller und Bobtail konnten bisher nur heterozygot von diesem Defekt betroffene Hunde (MDR1+/-) nachgewiesen werden, mit dem Auftreten homozygoter Mutationen müsste allerdings auch bei diesen Rassen gerechnet werden.
Beim Wäller ist es jedoch so, dass die Zuchttiere getestet sein müssen und bei der Verpaarung darauf geachtet wird, ein Trägertier nur mit einem freien zu verpaaren, damit es eben nicht zu homozygoten Welpen kommt.
Des Weiteren ist der Defekt bei folgenden Rassen bekannt: Deutscher Schäferhund, English Shepherd, McNab, Silken Windhound, Langhaarwhippet, Berger Blanc Suisse sowie einigen seltenen Rassen.
Seit Anfang 2008 werden außerdem weitere Rassen wie Barsoi, Belgischer Schäferhund oder Kelpie auf den Defekt untersucht.
Symptome, Diagnostik und Folgen für das Tier
Der Defekt im MDR1-Gen führt zu einer mangelhaften oder fehlenden Synthese des P-Glycoproteins. Dieses Eiweiß spielt eine Rolle bei ATP-abhängigen Transportvorgängen zwischen Blut und Gewebe und ist im Gehirn, in Leber, Nieren, Darm, Plazenta und Hoden zu finden. Neben seiner Funktion beim Transport körperfremder Stoffe, limitiert es den Transport der Hormone der Nebennierenrinde (Cortisol, Corticosteron) in das Gehirn und hat damit Einfluss auf die Hypothalamus-Hypophyse-Nebennierenrinden-Achse. Bei einem MDR1-Defekt kommt es daher zu einem erhöhten Übergang der Nebennierenrindenhormone in die übergeordneten Zentren und aufgrund des negativen Feedbacks zu erniedrigten Kortisolwerten im Blut.
Als eine weitere Folge des Defektes wird auch eine höhere Anfälligkeit für chronisch entzündliche Darmerkrankungen vermutet.
Bei nicht vom Defekt betroffenen Tieren dient dieses Protein u. a. dazu, körperfremde Stoffe wie Arzneimittel aus dem Körper herauszutransportieren. Es besteht also eine Art Resistenz gegenüber unerwünschten Nebenwirkungen – die sogenannte Multiple Drug Resistance.
Bekannt sind bisher die Auswirkungen auf die Blut-Hirn-Schranke. Bei dieser Grenze zwischen den Hirnblutgefässen und dem Hirnnervengewebe stellt ein sogenannter MDR1-Transporter eine Schutzbarriere für das Gehirn dar. Dieser Transporter ist Teil der Blut-Hirn-Schranke und befindet sich normalerweise auf der Oberfläche der Endothelzellen (Zellen, die die Wände der Blutgefäße auskleiden). Er sorgt dafür, dass toxische Verbindungen und Arzneistoffe in den Gehirnkapillaren zurückgehalten werden und nicht in das Gehirn eindringen können.
Besteht nun bei einem Hund der MDR1-Defekt, fehlt der Transporter und der Schutz funktioniert nicht mehr. Bei betroffenen Tieren können daher nach der Verabreichung von bestimmten Antiparasitika, Zytostatika, Durchfallmitteln oder Antibiotika starke neurotoxische Nebenwirkungen auftreten − bis zum Tod. Bei Mäusen, bei welchen der MDR1-Transporter bewusst ausgeschaltet wurde, traten nicht nur Ivermectin, sondern auch zahlreiche andere Arzneistoffe bis zu 90-fach mehr ins Gehirn als bei Vergleichstieren mit intakter Blut-Hirn-Schranke. Diese Stoffe sind auch eine potentielle Gefahr für einen vom MDR1-Defekt betroffenen Hund.
Mögliche Folge dieses Gendefektes ist die Überempfindlichkeit des Hundes gegenüber bestimmten Arzneistoffen. Da die Gabe einiger dieser Mittel bei betroffenen Hunden allerdings zum Tode führen kann, wird ein Gentest aller Hunde betroffener Rassen empfohlen. Die Universität Gießen bietet einen Test auf den MDR1-Defekt an. Zu diesem Zweck nimmt der Tierarzt dem zu untersuchenden Hund eine kleine Menge Blut ab (1 ml EDTA-Blut) und sendet diese Probe an die Universität. Mit Hilfe eines genetischen Tests wird die Blutprobe dann auf ein Vorliegen der MDR1-Mutation untersucht, dass Ergebnis wird dem Hundehalter mitgeteilt.
Ist der Hund vom Defekt betroffen, hat der Hundehalter einige Dinge zu beachten. So dürfen beispielsweise bestimmte Wurmkuren und Flohschutzmittel nicht mehr verabreicht werden. Auch bei Durchfall oder Herzerkrankungen eingesetzte Medikamente können weitreichende unerwünschte Nebenwirkungen haben. Bekannt ist eine Überempfindlichkeit z. B. für die Wirkstoffe Ivermectin, Doramectin, Moxidectin (nur bei oraler Anwendung) und Loperamid. Milbemycinoxim und Emodepsid dürfen nur unter exakter Dosierung eingesetzt werden. Viele weitere Wirkstoffe stehen aber in dem Verdacht, unerwünschte Nebenwirkungen hervorrufen zu können. Generell sollte daher der behandelnde Tierarzt über den Defekt informiert werden. Der Hund selber gilt als Risikopatient.
Bei Spaziergängen ist dann darauf zu achten, dass der Hund keinen Kot von beispielsweise Pferden zu sich nimmt, da dieser einen der gefährlichen Wirkstoffe in unveränderter Form enthalten kann.
Bisher sind Überempfindlichkeiten vor allen bei Hunden mit homozygoter Vererbung des MDR1-Defektes (MDR1 -/-) bekannt. Inzwischen wurden aber auch Reaktionen bei Trägern (MDR1 +/-) beobachtet. In einer US-amerikanischen Studie (siehe unter Links) werden die Träger deshalb als „sensitive“ bezeichnet, die vom Defekt betroffenen Hunde (MDR1 -/-) als „super sensitive“. Ebenfalls in den USA wurden die vom Defekt betroffenen Hunde inzwischen von der Forschung als Versuchstiere entdeckt.
Auswirkungen auf die Zucht
Aufgrund der Probleme in der Arzneitherapie von Hunden mit dem Genotyp MDR1(-/-) wird z. B. von der Universität in Gießen empfohlen, den Gendefekt in der Zucht betroffener Hunderassen zu berücksichtigen und so zu verpaaren, dass keine vom Defekt betroffenen Nachkommen entstehen können. Der MDR1-Genotyp eines Hundes ergibt sich aus der Kombination eines von väterlicher (+ oder -) und eines von mütterlicher Seite (+ oder -) vererbten Merkmals. „+“ steht dabei für ein intaktes MDR1-Gen und „-“ für ein defektes MDR1-Gen bezogen auf das Merkmal MDR1 nt230(del4). Für den MDR1-Genotyp eines Hundes gibt es drei verschiedene Möglichkeiten:
Nicht betroffen - MDR1(+/+), Merkmalsträger - MDR1(+/-) und Betroffen - MDR1(-/-).
Ist der MDR1-Genotyp zweier Zuchttiere bekannt, kann bereits eine theoretische Voraussage über die MDR1-Genotypen der Nachkommengeneration getroffen werden. Betroffene Tiere mit dem Genotyp MDR1(-/-) können aus einer Kreuzung der Genotypen MDR1(+/-) x MDR1(+/-), MDR1(+/-) x MDR1(-/-) oder MDR1(-/-) x MDR1(-/-) entstehen. Bei Kreuzung der Genotypen MDR1(+/+) x MDR1(-/-), MDR1(+/+) x MDR1(+/-), und MDR1(+/+) x MDR1(+/+) entstehen dagegen keine betroffenen MDR1(-/-) Tiere, aber außer bei MDR1(+/+) x MDR1(+/+) unter Umständen wieder Merkmalsträger.
Nachdem einige dem Verband für das Deutsche Hundewesen (VDH) angeschlossenen Zuchtvereine schon von sich aus diese Verpaarungsregeln beachtet hatten, hat der VDH diese den ihm angeschlossenen Collie- und Sheltiezuchtvereinen im Juni 2009 auferlegt. Ab November 2009 müssen nun sämtliche Zuchttiere auf den MDR1-Defekt getestet werden.
Ziel ist, keine vom Defekt betroffenen Nachkommen mehr zu erzeugen.
eingestellt von: ise; Quellennachweis
Meningitis-Arteriitis des Hundes
Die (steril-eitrige) Meningitis-Arteriitis des Hundes (auch Steroid-Responsive Meningitis-Arteriitis, SRMA, Beagle Pain Syndrome) ist eine relativ häufige, entzündliche Erkrankung des Rückenmarks bei Hunden, deren Ursache unbekannt ist.
Ätiologie und Pathogenese
Als auslösender Faktor für die Erkrankung wird eine Infektion oder ein Toxin vermutet. Dabei kommt es zu einer steril-eitrigen Entzündung der Rückenmarkshäute (Meningitis) und Blutgefäße (Arteriitis), vermutlich durch immunpathologische Vorgänge.
Die Erkrankung tritt vor allem bei Hunden mittelgroßer und großer Rassen im Alter von sechs bis 18 Monaten auf. Eine Rasseprädisposition ist für Beagle, Deutscher Boxer, Berner Sennenhund und Nova Scotia Duck Tolling Retriever beschrieben.
Klinisches Bild und Diagnose
Bei der akuten Form dominieren rezidivierende Schmerzen und Fieber sowie eine steife Halshaltung. Bei chronischem Verlauf kommt es zu weiteren neurologischen Ausfallerscheinungen wie Paresen, Ataxie, Anisokorie und Schielen.
Therapie
Die SRMA spricht auf eine Langzeitbehandlung mit Prednisolon meist gut an.
Die Therapie muss in der Regel über 6 Monate ausgedehnt werden. Anfänglich kann eine Gabe von Antibiotika sinnvoll sein, zumindest bis die bakteriologische Untersuchung des Liquor cerebrospinalis eine, bei Hunden seltene, bakterielle Meningitis ausschließt.
Bei frühzeitiger Behandlung und bei jungen Hunden ist die Prognose meist gut.
Ätiologie und Pathogenese
Als auslösender Faktor für die Erkrankung wird eine Infektion oder ein Toxin vermutet. Dabei kommt es zu einer steril-eitrigen Entzündung der Rückenmarkshäute (Meningitis) und Blutgefäße (Arteriitis), vermutlich durch immunpathologische Vorgänge.
Die Erkrankung tritt vor allem bei Hunden mittelgroßer und großer Rassen im Alter von sechs bis 18 Monaten auf. Eine Rasseprädisposition ist für Beagle, Deutscher Boxer, Berner Sennenhund und Nova Scotia Duck Tolling Retriever beschrieben.
Klinisches Bild und Diagnose
Bei der akuten Form dominieren rezidivierende Schmerzen und Fieber sowie eine steife Halshaltung. Bei chronischem Verlauf kommt es zu weiteren neurologischen Ausfallerscheinungen wie Paresen, Ataxie, Anisokorie und Schielen.
Therapie
Die SRMA spricht auf eine Langzeitbehandlung mit Prednisolon meist gut an.
Die Therapie muss in der Regel über 6 Monate ausgedehnt werden. Anfänglich kann eine Gabe von Antibiotika sinnvoll sein, zumindest bis die bakteriologische Untersuchung des Liquor cerebrospinalis eine, bei Hunden seltene, bakterielle Meningitis ausschließt.
Bei frühzeitiger Behandlung und bei jungen Hunden ist die Prognose meist gut.
eingestellt von: ise; Quellennachweis
Myasthenia gravis
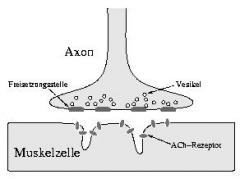
Die Myasthenia gravis pseudoparalytica (von „Schwäche“, „schwer“,„falsch“ und „Lähmung“; Kürzel: MG) bzw. laut ICD-10 vereinfacht Myasthenia gravis, gehört zu einer Gruppe von neurologischen Erkrankungen, die durch eine gestörte Signalübertragung zwischen Nerv und Muskel gekennzeichnet sind, und als Störungen der neuromuskulären Erregungsübertragung oder als myasthene Syndrome zusammengefasst werden.
Sie ist eine Autoimmunerkrankung, bei der eine Störung an der motorischen Endplatte der quergestreiften Muskulatur (Skelettmuskulatur) vorliegt, deren Ursache aber nicht völlig erforscht ist.
Das Krankheitsbild der Myasthenia gravis ist gekennzeichnet durch eine belastungsabhängige Muskelschwäche die die oben genannte Muskulatur häufig asymmetrisch befällt, auch einzelne oder mehrere Muskeln, unabhängig von der Körperhälfte. Zur Hauptsymptomatik gehört ihre wechselnde Ausprägung, beispielsweise neben dem Wechsel betroffener Muskeln, kann sie oft im Tagesverlauf spontan ohne erkennbaren Grund zunehmen und/oder es kann eine Erholung der betroffenen Muskeln in Ruhe, ebenso plötzlich wieder eintreten.
Die Myasthenia gravis kommt sowohl bei Menschen wie auch bei Tieren, besonders bei Haushunden vor.
Sie ist eine Autoimmunerkrankung, bei der eine Störung an der motorischen Endplatte der quergestreiften Muskulatur (Skelettmuskulatur) vorliegt, deren Ursache aber nicht völlig erforscht ist.
Das Krankheitsbild der Myasthenia gravis ist gekennzeichnet durch eine belastungsabhängige Muskelschwäche die die oben genannte Muskulatur häufig asymmetrisch befällt, auch einzelne oder mehrere Muskeln, unabhängig von der Körperhälfte. Zur Hauptsymptomatik gehört ihre wechselnde Ausprägung, beispielsweise neben dem Wechsel betroffener Muskeln, kann sie oft im Tagesverlauf spontan ohne erkennbaren Grund zunehmen und/oder es kann eine Erholung der betroffenen Muskeln in Ruhe, ebenso plötzlich wieder eintreten.
Die Myasthenia gravis kommt sowohl bei Menschen wie auch bei Tieren, besonders bei Haushunden vor.
eingestellt von: ise; Quellen- und Bildnachweis
Nekrotisierende Myelopathie des Kooiker-Hundes
Die Nekrotisierende Myelopathie des Kooiker-Hundes ist eine innerhalb der ersten drei Lebensmonate bei Kooiker-Hunden auftretende Degeneration der weißen Substanz, vor allem im Halsmark.
Sie äußert sich in gesteigerten Reflexen und schnell fortschreitenden Lähmungen.
Sie äußert sich in gesteigerten Reflexen und schnell fortschreitenden Lähmungen.
eingestellt von: ise; Quellennachweis
Wobbler-Syndrom
Als Wobbler-Syndrom wird in der Tiermedizin ein Symptomkomplex bezeichnet, der durch Nervenschädigungen im Bereich des Rückenmarks bzw. der Rückenmarksnerven im Bereich der Halswirbelsäule hervorgerufen wird (spinale Ataxie).
Der Begriff leitet sich vom unsicheren (ataktischen) Bewegungsablauf des erkrankten Tieres ab: „Wobbler“ kommt vom altdeutschen Wort „wobbeln“ („wackeln“, engl. to wobble).
Das Wobbler-Syndrom tritt vor allem bei Pferden und Hunden auf, als Ursache kommt eine Vielzahl unterschiedlicher Erkrankungen in Frage. Der Heilungserfolg hängt von der eigentlichen Ursache ab, einige Krankheiten haben eine gute, andere eine schlechte Prognose.
Die Symptome werden durch eine Schädigung des Halsmarks erzeugt, im Regelfall durch eine Kompression. Das Krankheitsbild entspricht damit der zervikalen Spinalkanalstenose des Menschen.
Die Kompression kann durch eine statische Verengung des Wirbelkanals zustande kommen (statischer Wobbler). Ein dynamischer Wobbler liegt vor, wenn das Rückenmark erst infolge einer Bewegung komprimiert wird.
Vorkommen
Das Wobbler-Syndrom wurde erstmals 1967 beim Basset Hound beschrieben.
Die Erkrankung kommt aber bei zahlreichen Hunderassen vor. In Studien aus Großbritannien und den USA zeigt sich eine deutliche Rassedisposition für Dobermann und Deutsche Dogge, die in einer Schweizer Studie allerdings nicht nachweisbar war.
Bislang wurde das Wobbler-Syndrom bei Airedale-Terrier, Alaskan Malamute, Australischer Schäferhund, Barsoi, Basset Hound, Beagle, Berner Sennenhund, Boston Terrier, Cocker Spaniel, Dackel, Dalmatiner, Deutscher Schäferhund, Lhasa-Apso, Neufundländer, Irischer Wolfshund, Kuvasz, Labrador Retriever, Pointer, Pudel, Pyrenäen-Berghund, Rhodesian Ridgeback, Riesenschnauzer, Rottweiler, Shih-Tzu und Weimaraner beschrieben.
Große Hunderassen sind deutlich häufiger betroffen, männliche Hunde etwa doppelt so häufig wie weibliche.
Klinisches Bild
Entsprechend der zahlreichen Ursachen und damit unterschiedlichen Lokalisation ist das klinische Bild sehr variabel.
Von Bedeutung ist darüber hinaus, ob die weiße Substanz des Rückenmarks eher im Bereich des Hinterstrangs (sensible Bahnen) oder Ventrolateralstrangs (absteigende motorische Bahnen) auftritt.
Die Ataxie entwickelt sich zumeist allmählich und tritt an den hinteren Extremitäten eher zutage als an den vorderen. Der schleichende Verlauf führt oft dazu, dass der Hundebesitzer die Erkrankung lange Zeit nicht ernst nimmt. Lediglich in 15 % der Fälle tritt ein Wobbler-Syndrom schlagartig in Form einer Para- oder Tetraplegie auf.
Häufigstes Bild sind Gangstörungen. Der Gang ist unsicher und beim Vorführen werden die Pfoten meist über den Boden gestrichen, was zu einer verstärkten Abnutzung der Krallen führt. Die Tiere stehen häufig breitbeinig da. Im weiteren Verlauf können Schwierigkeiten beim Aufstehen auftreten.
Das Laufen im Kreis oder das Ausführen von Wendungen macht die Bewegungsstörung meist deutlicher. Vor allem bei schnellerer Gangart kann die Schrittlänge der Vordergliedmaßen übertrieben vergrößert sein. Das Bewusstsein ist hier – im Gegensatz zu differentialdiagnostisch relevanten, entzündlichen Prozessen (Enzephalitis, Meningitis) – ungestört.
Eine Schmerzhaftigkeit des Halsbereichs ist auch bei Beugung und Streckung des Halses bei der Untersuchung nicht immer vorhanden. Die betroffenen Hunde bewegen jedoch den Halsbereich meist nur unwillig von selbst. Sehr selten kann jedoch Schmerz im Halsbereich das einzige Symptom sein und neurologische Ausfälle fehlen.
Diagnostik
Neurologische Untersuchung
Zunächst werden die Haltungs- und Stellungsreaktionen (Schubkarrenprobe, Unterstützungsreaktion, Hüpfreaktion, Aufrichtungsreaktion, Tischkantenprobe, Korrekturreaktion) geprüft. Die Reaktionen sind zumeist herabgesetzt oder verzögert, können aber bei milder Ausprägung auch physiologisch sein.
Röntgen
Die Röntgendiagnostik ist für die Diagnosestellung unverzichtbar. Da der Patient hier optimal gelagert werden muss, ist sie bei Hunden praktisch nur unter einer Kurznarkose sinnvoll durchführbar [6]. Aufnahmen werden im seitlichen und ventrodorsalen (von der Halsunterseite her) Strahlengang in Normalstellung sowie bei gebeugtem Hals durchgeführt.
CT und MRT
Eine Computertomographie (CT) kann in unsicheren Fällen die diagnostische Sicherheit erhöhen. Sie wird zumeist im Anschluss an eine Myelografie durchgeführt, um den Untersuchungsbereich einzugrenzen. Hierbei wird ebenfalls mit Kontrastmittelgabe (CT-Myelografie) gearbeitet, eventuelle Veränderungen im Halswirbelbereich lassen sich damit relativ sicher diagnostizieren.
Limitierende Faktoren sind die hohen Kosten und die Tatsache, dass Computertomographen meist nur in spezialisierten Tierkliniken verfügbar sind. Zudem können die Hunde im Computertomographen praktisch nicht exakt positioniert werden, ein Halten der Tiere verbietet sich durch die Strahlenbelastung.
Therapie
Operative Therapie
Es gibt zwei prinzipielle Operationsmethoden: Dekompression und Stabilisierung der betroffenen Wirbelsegmente, die je nach Fall auch kombiniert werden können. Für die Wahl der richtigen Therapie ist eine exakte Diagnose unabdingbar.
Das Standardverfahren bei Bandscheibenvorfällen ist der sogenannte „ventral slot“. Hierbei wird von der Unterseite des Halses zur Bandscheibe vorgegangen, die Unterseite des Anulus fibrosus der Bandscheibe entfernt, ein Loch in den Wirbelkörper gefräst und das vorgefallene Bandscheibenmaterial entfernt. Bei mehr seitlich und weiter rückenwärts lokalisiertem Bandscheibenvorfall ist die (dorsale) Laminektomie Standardmethode. Hierbei wird der Wirbelbogen (also das Dach des Wirbelkanals) des verengten Bereichs entfernt, so dass das Rückenmark einer Kompression von unten nach oben ausweichen kann.
Dieser Eingriff ist deutlich schwieriger und riskanter als der ventral slot, eine eventuelle Verletzung der Wirbelarterie kann zum Verbluten führen.
Konservative Therapie
Das Wobbler-Syndrom gilt zwar prinzipiell als chirurgisch zu behandeln. Da aber auch der chirurgische Eingriff mit Risiken verbunden ist, kann bei milden Formen und stabilen Verläufen ohne deutliche Verschlechterung des Zustands eine konservative Therapie ausreichend sein.
Sie umfasst eine strikte Ruhigstellung des Hundes (kurze Spaziergänge, Leinenzwang, Unterbinden von Spielen und Sprüngen, Verwendung eines Brustgeschirrs). Bei jungen Hunden ist eine Überprüfung der Futterzusammensetzung (Calcium) sinnvoll. Bei akuten Schmerzen können analgetisch wirkende nichtsteroidale Antiphlogistika eingesetzt werden.
Der Begriff leitet sich vom unsicheren (ataktischen) Bewegungsablauf des erkrankten Tieres ab: „Wobbler“ kommt vom altdeutschen Wort „wobbeln“ („wackeln“, engl. to wobble).
Das Wobbler-Syndrom tritt vor allem bei Pferden und Hunden auf, als Ursache kommt eine Vielzahl unterschiedlicher Erkrankungen in Frage. Der Heilungserfolg hängt von der eigentlichen Ursache ab, einige Krankheiten haben eine gute, andere eine schlechte Prognose.
Die Symptome werden durch eine Schädigung des Halsmarks erzeugt, im Regelfall durch eine Kompression. Das Krankheitsbild entspricht damit der zervikalen Spinalkanalstenose des Menschen.
Die Kompression kann durch eine statische Verengung des Wirbelkanals zustande kommen (statischer Wobbler). Ein dynamischer Wobbler liegt vor, wenn das Rückenmark erst infolge einer Bewegung komprimiert wird.
Vorkommen
Das Wobbler-Syndrom wurde erstmals 1967 beim Basset Hound beschrieben.
Die Erkrankung kommt aber bei zahlreichen Hunderassen vor. In Studien aus Großbritannien und den USA zeigt sich eine deutliche Rassedisposition für Dobermann und Deutsche Dogge, die in einer Schweizer Studie allerdings nicht nachweisbar war.
Bislang wurde das Wobbler-Syndrom bei Airedale-Terrier, Alaskan Malamute, Australischer Schäferhund, Barsoi, Basset Hound, Beagle, Berner Sennenhund, Boston Terrier, Cocker Spaniel, Dackel, Dalmatiner, Deutscher Schäferhund, Lhasa-Apso, Neufundländer, Irischer Wolfshund, Kuvasz, Labrador Retriever, Pointer, Pudel, Pyrenäen-Berghund, Rhodesian Ridgeback, Riesenschnauzer, Rottweiler, Shih-Tzu und Weimaraner beschrieben.
Große Hunderassen sind deutlich häufiger betroffen, männliche Hunde etwa doppelt so häufig wie weibliche.
Klinisches Bild
Entsprechend der zahlreichen Ursachen und damit unterschiedlichen Lokalisation ist das klinische Bild sehr variabel.
Von Bedeutung ist darüber hinaus, ob die weiße Substanz des Rückenmarks eher im Bereich des Hinterstrangs (sensible Bahnen) oder Ventrolateralstrangs (absteigende motorische Bahnen) auftritt.
Die Ataxie entwickelt sich zumeist allmählich und tritt an den hinteren Extremitäten eher zutage als an den vorderen. Der schleichende Verlauf führt oft dazu, dass der Hundebesitzer die Erkrankung lange Zeit nicht ernst nimmt. Lediglich in 15 % der Fälle tritt ein Wobbler-Syndrom schlagartig in Form einer Para- oder Tetraplegie auf.
Häufigstes Bild sind Gangstörungen. Der Gang ist unsicher und beim Vorführen werden die Pfoten meist über den Boden gestrichen, was zu einer verstärkten Abnutzung der Krallen führt. Die Tiere stehen häufig breitbeinig da. Im weiteren Verlauf können Schwierigkeiten beim Aufstehen auftreten.
Das Laufen im Kreis oder das Ausführen von Wendungen macht die Bewegungsstörung meist deutlicher. Vor allem bei schnellerer Gangart kann die Schrittlänge der Vordergliedmaßen übertrieben vergrößert sein. Das Bewusstsein ist hier – im Gegensatz zu differentialdiagnostisch relevanten, entzündlichen Prozessen (Enzephalitis, Meningitis) – ungestört.
Eine Schmerzhaftigkeit des Halsbereichs ist auch bei Beugung und Streckung des Halses bei der Untersuchung nicht immer vorhanden. Die betroffenen Hunde bewegen jedoch den Halsbereich meist nur unwillig von selbst. Sehr selten kann jedoch Schmerz im Halsbereich das einzige Symptom sein und neurologische Ausfälle fehlen.
Diagnostik
Neurologische Untersuchung
Zunächst werden die Haltungs- und Stellungsreaktionen (Schubkarrenprobe, Unterstützungsreaktion, Hüpfreaktion, Aufrichtungsreaktion, Tischkantenprobe, Korrekturreaktion) geprüft. Die Reaktionen sind zumeist herabgesetzt oder verzögert, können aber bei milder Ausprägung auch physiologisch sein.
Röntgen
Die Röntgendiagnostik ist für die Diagnosestellung unverzichtbar. Da der Patient hier optimal gelagert werden muss, ist sie bei Hunden praktisch nur unter einer Kurznarkose sinnvoll durchführbar [6]. Aufnahmen werden im seitlichen und ventrodorsalen (von der Halsunterseite her) Strahlengang in Normalstellung sowie bei gebeugtem Hals durchgeführt.
CT und MRT
Eine Computertomographie (CT) kann in unsicheren Fällen die diagnostische Sicherheit erhöhen. Sie wird zumeist im Anschluss an eine Myelografie durchgeführt, um den Untersuchungsbereich einzugrenzen. Hierbei wird ebenfalls mit Kontrastmittelgabe (CT-Myelografie) gearbeitet, eventuelle Veränderungen im Halswirbelbereich lassen sich damit relativ sicher diagnostizieren.
Limitierende Faktoren sind die hohen Kosten und die Tatsache, dass Computertomographen meist nur in spezialisierten Tierkliniken verfügbar sind. Zudem können die Hunde im Computertomographen praktisch nicht exakt positioniert werden, ein Halten der Tiere verbietet sich durch die Strahlenbelastung.
Therapie
Operative Therapie
Es gibt zwei prinzipielle Operationsmethoden: Dekompression und Stabilisierung der betroffenen Wirbelsegmente, die je nach Fall auch kombiniert werden können. Für die Wahl der richtigen Therapie ist eine exakte Diagnose unabdingbar.
Das Standardverfahren bei Bandscheibenvorfällen ist der sogenannte „ventral slot“. Hierbei wird von der Unterseite des Halses zur Bandscheibe vorgegangen, die Unterseite des Anulus fibrosus der Bandscheibe entfernt, ein Loch in den Wirbelkörper gefräst und das vorgefallene Bandscheibenmaterial entfernt. Bei mehr seitlich und weiter rückenwärts lokalisiertem Bandscheibenvorfall ist die (dorsale) Laminektomie Standardmethode. Hierbei wird der Wirbelbogen (also das Dach des Wirbelkanals) des verengten Bereichs entfernt, so dass das Rückenmark einer Kompression von unten nach oben ausweichen kann.
Dieser Eingriff ist deutlich schwieriger und riskanter als der ventral slot, eine eventuelle Verletzung der Wirbelarterie kann zum Verbluten führen.
Konservative Therapie
Das Wobbler-Syndrom gilt zwar prinzipiell als chirurgisch zu behandeln. Da aber auch der chirurgische Eingriff mit Risiken verbunden ist, kann bei milden Formen und stabilen Verläufen ohne deutliche Verschlechterung des Zustands eine konservative Therapie ausreichend sein.
Sie umfasst eine strikte Ruhigstellung des Hundes (kurze Spaziergänge, Leinenzwang, Unterbinden von Spielen und Sprüngen, Verwendung eines Brustgeschirrs). Bei jungen Hunden ist eine Überprüfung der Futterzusammensetzung (Calcium) sinnvoll. Bei akuten Schmerzen können analgetisch wirkende nichtsteroidale Antiphlogistika eingesetzt werden.
eingestellt von: ise; Quellen- und Bildnachweis
x

Quellen- und Bildnachweis

Bildname:
Röntgenaufnahme einer angeborenen Wirbelkanalverengung am Halswirbel
Urheber:
Wikipedia/Kalumet
Link:
Neuen Eintrag erstellen  Hundefutter-LexikonEin ständiges Thema: Was ist das beste Futter für meinen Hund!Nassfutter oder Trockenfutter, für wellches Alter geeignet und mit welchen Inhaltsstoffen, das sind Fragen mit denen sich der verantwortungsbewusste Tierhalter in der Regel
Hundefutter-LexikonEin ständiges Thema: Was ist das beste Futter für meinen Hund!Nassfutter oder Trockenfutter, für wellches Alter geeignet und mit welchen Inhaltsstoffen, das sind Fragen mit denen sich der verantwortungsbewusste Tierhalter in der Regel Giftköderwarnung per SMS & MailNeu im DOOGGS-Portal!Aktuell bietet Dooggs, das Hunde-Informations- und Empfehlungsportal allen DOOGGS-Usern die Möglichkeit, Giftköder-Meldungen im Umkreis des Wohnortes per SMS oder E-Mail zu
Giftköderwarnung per SMS & MailNeu im DOOGGS-Portal!Aktuell bietet Dooggs, das Hunde-Informations- und Empfehlungsportal allen DOOGGS-Usern die Möglichkeit, Giftköder-Meldungen im Umkreis des Wohnortes per SMS oder E-Mail zu Einstieg in die Dooggs-Portal-Werbung | Basic-Paket!Sie suchen eine sehr günstige Möglichkeit im Dooggs-Portal zu werben?, Sie bieten Dienstleistungen zum Thema rund um den Hund an?, Dann ist unser Einsteiger-Werbe-Paket Basic
Einstieg in die Dooggs-Portal-Werbung | Basic-Paket!Sie suchen eine sehr günstige Möglichkeit im Dooggs-Portal zu werben?, Sie bieten Dienstleistungen zum Thema rund um den Hund an?, Dann ist unser Einsteiger-Werbe-Paket Basic Die mobile Trimmtante mit Herz!Das bin ich. Sarah Morich, geboren am 08.07.1991 in Herzberg am Harz. Seitdem ich mich erinnern kann, sind wir im Besitz von Hunden.2014 sagte ich mir.. warum, nicht Hobby zum Beruf gesagt, getan.. Ich machte mich selbständig als mobile
Die mobile Trimmtante mit Herz!Das bin ich. Sarah Morich, geboren am 08.07.1991 in Herzberg am Harz. Seitdem ich mich erinnern kann, sind wir im Besitz von Hunden.2014 sagte ich mir.. warum, nicht Hobby zum Beruf gesagt, getan.. Ich machte mich selbständig als mobile Traumhund - Training für Mensch und Hund im Kreis SoestTraumhund - Hundetraining im Kreis Soest hilft Ihnen dabei, den für Sie beide passenden Weg zu finden:Traumhund-Hundetraining – Teamwork macht
Traumhund - Training für Mensch und Hund im Kreis SoestTraumhund - Hundetraining im Kreis Soest hilft Ihnen dabei, den für Sie beide passenden Weg zu finden:Traumhund-Hundetraining – Teamwork macht Z.O.P.F Hundeschule in Villingen-SchwenningenTraining ohne Leckerchen?!Ja, es ist möglich, sofern der Hund sich durch andere Dinge motivieren lässt. Das können Streicheleinheiten sein, einfach nur Nähe, Spielzeug oder Dinge, die der Hund grade lieber machen möchte.Manche
Z.O.P.F Hundeschule in Villingen-SchwenningenTraining ohne Leckerchen?!Ja, es ist möglich, sofern der Hund sich durch andere Dinge motivieren lässt. Das können Streicheleinheiten sein, einfach nur Nähe, Spielzeug oder Dinge, die der Hund grade lieber machen möchte.Manche Schönhalde Tierbestattung in AlbstadtDamit Ihr Freund unvergessen bleibt!Man wünscht sich, dass man uns nie braucht...…aber wenn die Zeit kommt, dann ist es schön, jemand Erfahrenes an der Hand zu haben.Wir machen diese wichtige Arbeit mit viel Herz und Einfühlungsvermögen.Die
Schönhalde Tierbestattung in AlbstadtDamit Ihr Freund unvergessen bleibt!Man wünscht sich, dass man uns nie braucht...…aber wenn die Zeit kommt, dann ist es schön, jemand Erfahrenes an der Hand zu haben.Wir machen diese wichtige Arbeit mit viel Herz und Einfühlungsvermögen.Die
DOOGGS NEWS
 Hundefutter-LexikonEin ständiges Thema: Was ist das beste Futter für meinen Hund!Nassfutter oder Trockenfutter, für wellches Alter geeignet und mit welchen Inhaltsstoffen, das sind Fragen mit denen sich der verantwortungsbewusste Tierhalter in der Regel
Hundefutter-LexikonEin ständiges Thema: Was ist das beste Futter für meinen Hund!Nassfutter oder Trockenfutter, für wellches Alter geeignet und mit welchen Inhaltsstoffen, das sind Fragen mit denen sich der verantwortungsbewusste Tierhalter in der Regel Giftköderwarnung per SMS & MailNeu im DOOGGS-Portal!Aktuell bietet Dooggs, das Hunde-Informations- und Empfehlungsportal allen DOOGGS-Usern die Möglichkeit, Giftköder-Meldungen im Umkreis des Wohnortes per SMS oder E-Mail zu
Giftköderwarnung per SMS & MailNeu im DOOGGS-Portal!Aktuell bietet Dooggs, das Hunde-Informations- und Empfehlungsportal allen DOOGGS-Usern die Möglichkeit, Giftköder-Meldungen im Umkreis des Wohnortes per SMS oder E-Mail zu Einstieg in die Dooggs-Portal-Werbung | Basic-Paket!Sie suchen eine sehr günstige Möglichkeit im Dooggs-Portal zu werben?, Sie bieten Dienstleistungen zum Thema rund um den Hund an?, Dann ist unser Einsteiger-Werbe-Paket Basic
Einstieg in die Dooggs-Portal-Werbung | Basic-Paket!Sie suchen eine sehr günstige Möglichkeit im Dooggs-Portal zu werben?, Sie bieten Dienstleistungen zum Thema rund um den Hund an?, Dann ist unser Einsteiger-Werbe-Paket Basic Die mobile Trimmtante mit Herz!Das bin ich. Sarah Morich, geboren am 08.07.1991 in Herzberg am Harz. Seitdem ich mich erinnern kann, sind wir im Besitz von Hunden.2014 sagte ich mir.. warum, nicht Hobby zum Beruf gesagt, getan.. Ich machte mich selbständig als mobile
Die mobile Trimmtante mit Herz!Das bin ich. Sarah Morich, geboren am 08.07.1991 in Herzberg am Harz. Seitdem ich mich erinnern kann, sind wir im Besitz von Hunden.2014 sagte ich mir.. warum, nicht Hobby zum Beruf gesagt, getan.. Ich machte mich selbständig als mobile Traumhund - Training für Mensch und Hund im Kreis SoestTraumhund - Hundetraining im Kreis Soest hilft Ihnen dabei, den für Sie beide passenden Weg zu finden:Traumhund-Hundetraining – Teamwork macht
Traumhund - Training für Mensch und Hund im Kreis SoestTraumhund - Hundetraining im Kreis Soest hilft Ihnen dabei, den für Sie beide passenden Weg zu finden:Traumhund-Hundetraining – Teamwork macht Z.O.P.F Hundeschule in Villingen-SchwenningenTraining ohne Leckerchen?!Ja, es ist möglich, sofern der Hund sich durch andere Dinge motivieren lässt. Das können Streicheleinheiten sein, einfach nur Nähe, Spielzeug oder Dinge, die der Hund grade lieber machen möchte.Manche
Z.O.P.F Hundeschule in Villingen-SchwenningenTraining ohne Leckerchen?!Ja, es ist möglich, sofern der Hund sich durch andere Dinge motivieren lässt. Das können Streicheleinheiten sein, einfach nur Nähe, Spielzeug oder Dinge, die der Hund grade lieber machen möchte.Manche Schönhalde Tierbestattung in AlbstadtDamit Ihr Freund unvergessen bleibt!Man wünscht sich, dass man uns nie braucht...…aber wenn die Zeit kommt, dann ist es schön, jemand Erfahrenes an der Hand zu haben.Wir machen diese wichtige Arbeit mit viel Herz und Einfühlungsvermögen.Die
Schönhalde Tierbestattung in AlbstadtDamit Ihr Freund unvergessen bleibt!Man wünscht sich, dass man uns nie braucht...…aber wenn die Zeit kommt, dann ist es schön, jemand Erfahrenes an der Hand zu haben.Wir machen diese wichtige Arbeit mit viel Herz und Einfühlungsvermögen.Die